
SARS-CoV-2: Yeni koronavirüs
Koronavirüs SARS-CoV-2, virüs kabuğunu oluşturan moleküllerden, bir konak hücreyi ve içindeki RNA genomunu enfekte etmesine izin veren çıkıntılı sivri uçlardan oluşur. Bir insan hücresi enfekte olduğunda virüs, daha fazla protein molekülü için plan yapar ve yeni kopyalarını üretmek için konakçı hücreyi ele geçirir. Bunun nasıl çalıştığını daha ayrıntılı olarak öğrenmek isterseniz, burada açıklamalarla birlikte animasyonlu bir viral yaşam döngüsü bulabilirsiniz. Daha önce de, bu virüsün gen, genom ve proteinlerini bir blog yazımızda burada işlemiştik. Ancak, o zamandan bu yana yeni gelişmeler var ve aşağıda özetlenmiş…

Yapım döngüsü
Virüsün hücremize girişi
SARS-CoV-2 ile enfeksiyon, konakçı hücre reseptörü anjiyotensin dönüştürücü enzim 2‘ye (ACE2) bağlanan glikozile edilmiş Spike (başak veya diğer bir adı ile diken) proteinleri yoluyla konakçı hücreye girildiğinde başlar.

Yapışmadan sonra SARS-CoV-2, proteaz bölünmesi ve aktivasyonu ile yönlendirilerek hücre zarından endositoz veya füzyon yoluyla konakçı hücreye girer. SARS-CoV-2 daha sonra kendi genomik +RNA’sını (ifade edilen veya anlamlı RNA zinciri) viral RNA ve protein sentezi için konakçı hücrenin içine (sitozol) salar.
NSP’lerin çevirisi (Translasyon)

Viral genom yaklaşık 30 kb uzunluğundadır. Genomun üçte ikisi poliprotein pp1a ve pp1ab’yi kodlarken, kalan üçte biri zarf (E), zar (M), nükleokapsid (N) ve başak (S) proteinleri dahil olmak üzere yapısal proteinleri kodlayan genlerden oluşur. Sitozolde, viral genomik RNA’lar konakçı ribozom mekanizması tarafından poliprotein pp1a ve pp1ab’ye çevrilir ve bunlar daha sonra proteolitik olarak işlenir.
Bölünme

Poliproteinler pp1a ve pp1ab, viral proteazlar nsp3 ve nsp5 tarafından daha küçük yapısal olmayan proteinlere (nsps) bölünür.Nsp3; nsp4 ve nsp6 ile çift zarlı veziküllerin (DMV’ler) veya diğer bir adı ile torbacıkların oluşumunda da rol alan bir membran proteinidir. Nsp12; nsp7 ve nsp8 ile replikaz-transkriptaz kompleksinin kor yapısını oluşturan RNA’ya bağımlı bir RNA polimerazdır. Nsp14, nsp10’un da yardımı ile hem hata (yani mutasyon) düzeltme hem de zincri tekrar birleştirme aktivitelerine sahip bir ekzoribonükleazdır (bu enzimin yani Nsp14+Nsp10 kompleksinin diğer bir adı ExoN’dur). ExoN önemli bir ilaç hedefi olabilir. Çünkü, bu enzimi susturursan virüs replike olurken çok hata yapar ve muhtemelen daha az bulaşıcı ve patojenik olur. Nsp16 ve helikaz, nsp13, RNA başlığının oluşumunda da rol oynar.
Replikasyon ve transkripsiyon

Viral RNA sentezi, hücre içi zarlardan modifiye edilmiş çift zarlı veziküllerde (DMV’ler) meydana gelir. DMV içinde, viral RNA’lar, süreksiz transkripsiyon yoluyla genomik pozitif anlamlı RNA’ların ve subgenomik negatif iplikli RNA’ların sentezi için kullanılabilen tam uzunlukta negatif sarmallı RNA’lar üretmek için kopyalanır. Subgenomik negatif sarmallı RNA’lar ayrıca subgenomik pozitif sarmallı RNA’lara kopyalanır. Bu pozitif sarmallı RNA’lar, viral proteinlerin translasyonu için DMV’lerin çift membranını kaplayan moleküler gözenekler (por) yoluyla sitozole aktarılır.
Yapısal proteinlerin çevirisi
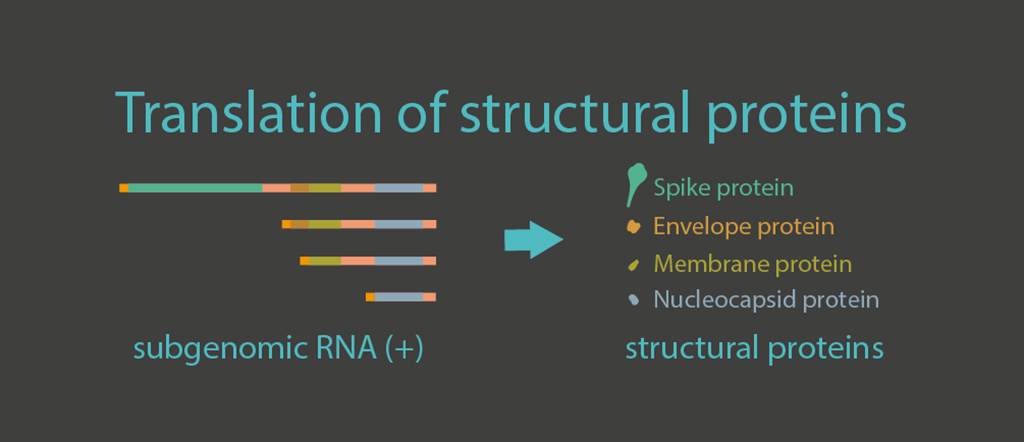
Viral genomun üçte biri, zarf (E), zar (M), nükleokapsid (N) ve başak (S) proteinleri dahil olmak üzere yapısal proteinleri kodlayan genlerden oluşur. Bu yapısal proteinlerin transkriptleri çift zarlı veziküller içinde oluşturulur ve daha sonra sitozol ve ER’ye (endoplazmik retikulum) aktarılır ve burada proteinlere çevrilir. E ve M proteinleri, virüs montajı ve tomurcuklanma için gerekli olan küçük zar proteinleridir. N (nükleokapsit) proteini ise viral genomik RNA’yı yoğunlaştırır, böylece küçük virionun içine paketlenebilir. S proteini, reseptör tanıma ve hücre zarı füzyon sürecinde önemli bir rol oynar.
Montaj

Viral genomik pozitif sarmallı RNA’lar ve N proteinleri, Endoplazmik Retikulum-Golgi ara bölmesine (ERGIC) giren nükleokapsidler halinde birleşir. ERGIC membranlarında bulunan yapısal proteinler, virion formları olarak zarfın içine dahil edilir.
Ekzositoz
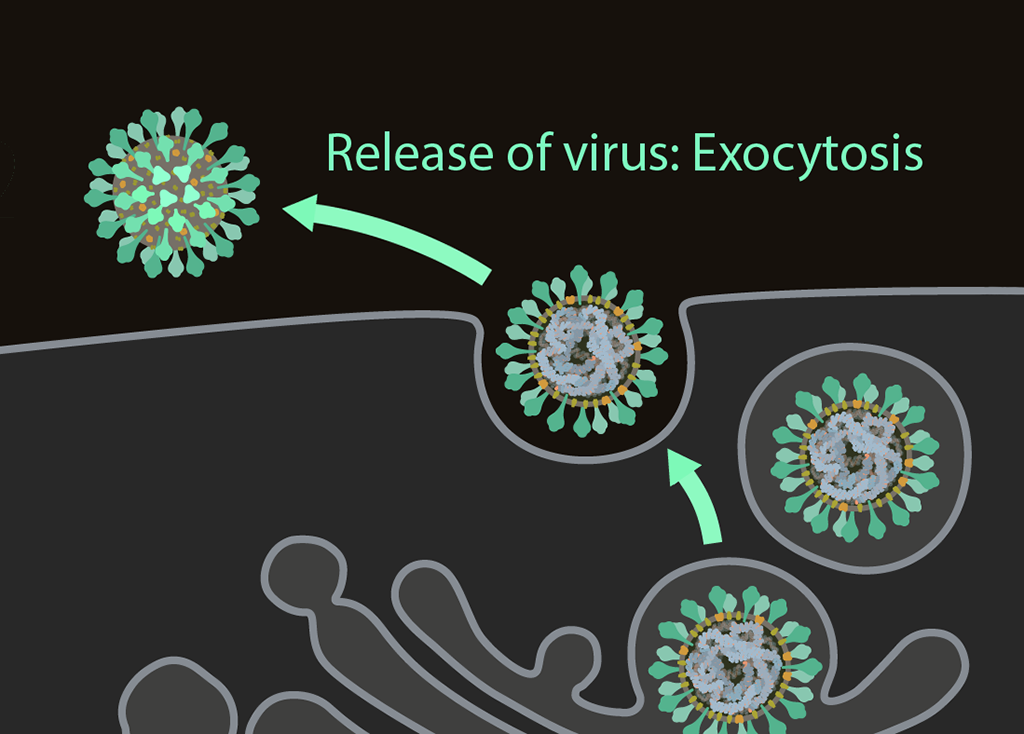
Yapım (kendini inşa etme) döngülerini tamamladıktan sonra, virüsler daha fazla bulaşma için ekzositoz yoluyla hücreden salınmaya hazırdır.
Yapıtaşı proteinleri
Spike
Başak proteini (yüzey glikoproteini, S-proteini olarak da bilinir) virüs kabuğundan (alt, bej) dışarıya sarkılı bulunur ve konakçı hücreye girişe aracılık eder.

Bir protein üç özdeş kopyadan (yeşil renkli bir homo-trimer) oluşur ve anjiyotensin dönüştürücü enzim 2 adı verilen hücresel reseptöre bağlanır (gösterilmemiştir). Bu bağlanma, hücre ve virüs zarının füzyonuna yol açan bir dizi olayı tetikler. Ön füzyon trimerinin istikrarsızlaştırılmasından sonra, başak proteinin bir kısmı atılır ve bu da kararlı bir füzyon sonrası konformasyona geçişe yol açar. Bir konakçı hücre reseptörünü devreye sokmak için, Spike proteinin reseptör bağlanma alanı, menteşe benzeri bir konformasyonel yeniden düzenlemeye tabi tutulur. SARS-CoV-2’nin konakçı hücre ile bu bağlanma, giriş ve füzyon mekanizması hala tam olarak anlaşılamamıştır. Başak proteini yoğun bir şekilde glikozile edilmiştir (gri), yani protein yüzeyinde sümüksü bir yüzey oluşturan şeker zincirleri taşır ve bağışıklık sisteminin başak proteinini tanımasını zorlaştırır. Glikozilasyon tipi, proteinin üretildiği konakçı hücreye bağlıdır.
Ana Proteaz

SARS-CoV-2’nin RNA genomu, viral girişten hemen sonra ilk kez proteinlere çevrildiğinde, fonksiyonel parçalara bölünmesi gereken, polipeptid adı verilen uzun bir protein üretilir. Bu olmadan virüs çoğalamaz ve bulaşma gerçekleşemez. Bu olay, iki proteaz, nsp3 ve ana proteaz (ayrıca 3C benzeri proteaz veya nsp5 olarak da bilinir) tarafından yapılır. Bu nedenle her ikisi de başlıca ilaç hedefleridir. Ana proteaz, iki özdeş proteinden (homodimer) oluşan bir dimer olarak çalışır, resim bu iki kopyayı (yeşil) potansiyel bir inhibitör (kırmızımsı) bağlı halde göstermektedir.
RNA polimeraz kompleksi (RdRp)

(Ayrıca, RNA’ya bağımlı RNA polimeraz, RdRp kompleksi, nsp12, nsp7, nsp8 olarak da bilinir). SARS-CoV-2, proteinlerini kodlamak için tek sarmallı pozitif zincir bir RNA kullanır ve bu nedenle “tek sarmallı RNA virüsleri” sınıfına aittir. Virüs, bu oldukça büyük RNA genomunu kopyalamak için “RNA’ya bağımlı RNA polimeraz” adı verilen özel bir proteine ihtiyaç duyar. Bu protein, bir ipteki boncuklar gibi tek ribonükleotitleri birbirine bağlayarak, RNA’nın yeni bir kopyasını oluşturmak için viral RNA’yı şablon (kalıp) olarak kullanır. RdRp (nsp12 olarak da adlandırılır) birkaç başka proteinin – nsp7, nsp8, nsp10 ve nsp14 – yardımı ile çalışır. Nsp7 ve nsp8, yeni yapılan RNA’nın polimerazı sorunsuz bir şekilde terk etmesi için bir rampa (“kayan kutuplar” olarak adlandırılır) sağlamak için birlikte çalışır. Bu gereksiz görünebilir, ancak polimeraz onsuz yeni RNA yapamaz! Nsp10/nsp14 (ExoN), yeni yapılmış RNA’yı düzeltmek için birlikte çalışır, hataları ortadan kaldırır, bu da SARS-CoV-2’nin böylesine büyük bir genoma sahip olmasını sağlar. Bu proteinler birlikte, virüsün kendisinin birçok yüksek kaliteli kopyasını yapmasını sağlayan karmaşık bir makine oluşturur.
EndoRNaz

EndoRNaz (ayrıca NendoU, nsp15 veya nidoviral RNA uridilata özgü endoribonükleaz olarak da bilinir), bir RNA dizisinin ortasında üridini (U) keserek 2′ ‐ 3 ′ siklik fosfodiester ve 5 ‐ hidroksil terminali ile sonuçlanan viral bir enzimdir. Bir nsp15 monomeri; N-terminal oligomerizasyon alanı, bir orta alan ve C-terminalinde katalitik NendoU alanı olmak üzere üç farklı alandan oluşur. Altı monomer daha sonra, fonksiyonel form olan bir N-terminal oligomerizasyon alanı ile kararlı kılınarak bir çift halkalı heksamer oluşturur. Nsp15, Mn2 + bağımlı bir endoribonükleazdır, yani bölme işini gerçekleştirmek aktif bölgesindeki metal manganın koordinasyonuna dayanır. Bu bölünmenin ve bir bütün olarak nsp15’in tam işlevi bilinmemektedir.
Nsp9

Nsp9’un (tek zincir RNA bağlayıcı protein) viral replikasyona ve virülansa aracılık ettiğine inanılmaktadır. Nsp9’un uzun oligonükleotid ipliklerini (tek zincir RNA) bağlayabildiği gösterilmiştir, proteinde hiçbir doğrudan etkileşim bölgesi tanımlanmamıştır. Nsp9’un koronavirüsler dışında görülmeyen benzersiz bir kıvrımı vardır; ancak, alt ailede homologlar bulunmuştur. Çözelti içinde zorunlu bir homodimer oluşturur ve bu dimeri bir GxxxG alfa sarmal motifi aracılığıyla oluşturduğu gözlenmiştir. Ek olarak, ana proteazın (nsp5) bölünme motifini (LEVL) içeren peptidlerin nsp9’a bağlanma afinitesine sahip olduğu gösterilmiştir. Bu peptitler, dimerizasyon bölgesi yapısıyla etkileşime girer, ancak dimerizasyonu engellemez. Sonuç olarak, gizemli bir protein.
Nsp3

Nsp3, 2000’den fazla amino asitten oluşur. Koronavirüsün genomu tarafından kodlanan en büyük protein olarak, yapısını ve işlevini çözmek çok büyük bir görevdir. Hiçbir nsp3 yapısı çözülmedi. Birkaç transmembran alanı vardır, bu da onu membrana bağlı bir protein yapar. Ayrıca bağışıklık sistemiyle çeşitli şekillerde etkileşerek bağışıklık tepkisini bastırır. En çok çalışılan alan (domeyn), tıpkı ana proteaz gibi polipeptitleri ayırma görevi görür. SARS-CoV-2’nin RNA’sı, viral girişten hemen sonra ilk kez proteinlere çevrildiğinde, fonksiyonel parçalara bölünmesi gereken uzun bir protein zinciri yani bir poli-peptit üretilir. İlk üç işlevsel parça, nsp1, nsp2 ve nsp3, nsp3’ün papain benzeri proteaz alanı tarafından bölünür. Bu aktivite olmadan virüs çoğalamaz ve bulaşma gerçekleşemez. Dolayısıyla, bu alan önemli bir ilaç hedefidir.
Lider protein

Lider protein (nsp1), enfeksiyondan sonra konakçı hücreyi yeniden yapılandırmaya başlar ve korona virüsleri arasında oldukça farklıdır. Ribozoma (40S alt birimi) bağlanır ve enfekte olmuş hücrenin kendi protein üretimini yavaşlatırken viral proteinlerin üretimini sağlar. Bu, hücrenin bir bağışıklık tepkisine yardımcı olmasını önlemeye yardımcı olur ve virüsün çoğalmasına yardımcı olmaya zorlar. Nsp1 ayrıca konakçı mRNA bölünmesini (ancak bir nükleazın kendisi değildir) ve konakçı hücrede henüz tam olarak anlaşılmayan çeşitli kimyasal değişiklikleri indükler.
RNA ve Nükleokapsid

SARS-CoV-2’nin genomu, tek sarmallı RNA’dır (insan hücrelerindeki DNA’ya benzemez). Bu RNA, konakçı hücre içine girdikten sonra hemen viral proteinlere çevrilebileceği anlamına gelir. Tek sarmallı olduğu için, RNA’daki herhangi bir hasar düzeltilemez çünkü yalnızca bir kopya mevcuttur. Buna ek olarak, genom, virüs dünyasındaki en büyük RNA genomlarından biridir ve virüsün kendisinin boyutuna da yansıyan bir gerçektir. RNA, virüs için çok değerli olduğu ve kabuğu çok kırılgan olduğu için, RNA, viral partikül içinde paketlendiğinde nükleokapsid proteinleri (gri) şeklinde ekstra bir koruma katmanına sahiptir. Muhtemelen nükleokapsid kompleksi tarafından oluşturulan iki sarmal oluğun etrafına çift sarmal bir şekilde sarılmıştır. Bununla birlikte, nükleobazlar (turuncu ve sarı), merdiven benzeri bir şekle sahip tipik bir RNA çift sarmalı oluşturmak için birbirinden çok uzaktır ve bazlar birbirine doğru bakmayabilir.
Viral zarf

Virüsün kabuğu, içinde virüsün yapıldığı konakçı hücreden elde edilen çift lipid (yağ) zarından (gri renkte gösterilmiştir) oluşur. Lipitlerin su seven (hidrofilik) kısımları dışarıya bakarken, su sevmeyen (hidrofobik) kısımlar zarın iç tarafına bakar. Bu düzenleme, virüsün neden sabunla yok edilebileceğini kolayca açıklar: sabun, çift-lipidik zarları çözer.
Daha fazla bilmek ister misin? Burada!
Spike proteinine ek olarak, bilipidik zara gömülü iki protein daha vardır: zar proteini ve zarf proteini. Membran proteini, konakçı hücrede viral makromoleküllerin birleşmesinde önemli bir rol oynar (her şeyin işlevsel olması için doğru şekilde paketlenmesini sağlamak). Bugüne kadar zar proteininin atomik yapısı belirlenmemiştir. Küçük zarf (E) proteini de viryonların oluşumunda önemli bir rol oynuyor gibi görünmektedir. E proteini olmadan, daha az virüs üretilir ve daha az virülenttir. E proteini, konakçı hücre zarlarında iyon taşıyıcıları (sarı) olarak görev yapan pentamerik gözenekler (por) oluşturur.
Metiltransferaz

RNA’nın metilasyon kaplamasını gerçekleştiren koronavirüs içinde iki metiltransferaz proteini (nsp14 ve nsp16) tanımlanmıştır. Bu kapaklama reaksiyonları, RNA’nın bozulmadan korunmasına yardımcı olmak için önemlidir, fakat aynı zamanda mRNA işleme ve doğuştan gelen bağışıklıkta da önemlidir. Nsp10 proteini (açık mavi), nsp14 ve nsp16 için bir aktivatördür. Nsp16 (koyu yeşil, sağda) viral mRNA’nın 2′-O’sunda metiltransferaz aktivitesine sahiptir. Nsp14 (eksonükleaz olarak da bilinir), viral replikasyon ve transkripsiyonda ikili fonksiyona sahip bir proteindir. Bunları birbirine bağlayan esnek bir bağlayıcı (gri) bulunan iki ana alan vardır. N-terminal alanı (açık yeşil), mutagenezi önlemek için RNA üretimini 3′-5 ‘yönünde düzelten bir ekzoribonükleaz fonksiyonuna sahiptir (bkz. RNA polimeraz kompleksi). Düzeltici bir enzimin varlığı, SARS-CoV2’nin büyük genomununun (29.8 kilobaz uzunluğunda) nispeten hatasız kopyalanmasını kolaylaştırır.
Hepatit C (9.6 kilobaz) veya Lassavirüs (İki RNA ipliği, her biri 3.4 kilobaz) gibi diğer RNA virüsleri, önemli ölçüde daha küçük genomları nedeniyle bir ekzoribonükleaz enzimini kodlamaz.
C-terminal alanı (koyu yeşil), viral mRNA’nın 5 ‘ucunun N7 kaplaması için metil transferaz aktivitesine sahiptir. Bugüne kadar, SARS-CoV2’den hiçbir nsp14 net bir şekilde çözülememiştir, ancak SARS-CoV’de, SARS-CoV-2’nin nsp14’ne %95 sekans özdeşliğine sahip birkaç yapı vardır.
Aksesuar proteinler

Aksesuar proteinler, in vitro viral replikasyon için gerekli değildir ve diğer proteinlerden daha az çalışılmıştır. SARS-CoV genomu içindeki konumlarına göre isimlendirilmişlerdir. RNA dizilerinin, çeşitli Açık Okuma Çerçeveleri (ORF’ler) aracılığıyla farklı proteinleri kodladığı bulunmuştur. Bu, proteinler için RNA üzerindeki başlangıç noktasının değişebileceği ve aynı RNA dizisi tarafından çeşitli proteinlerin üretilmesine neden olabileceği anlamına gelir. Örneğin RNA, nereden başladığınıza bağlı olarak ORF9b ve Nucleocapsid için eş zamanlı kodlama yapabilir. ORF3, SARS-CoV-2’de sadece 22 amino asit uzunluğunda, ancak SARS-CoV’de 154 amino asit uzunluğundadır.
Konakçı hücrede bağışıklık tepkisinin önemli bir parçası olan interferonu baskıladığı gösterilmiştir. ORF3 ne kadar uzun olursa bağışıklık sisteminin o kadar iyi baskılanabileceği gösterildi. ORF3 ayrıca, konakçı hücrenin, virionların atılımına karşı geçirgen hale getirilmesinde önemli bir rol oynar gibi görünmektedir ve Spike, zar ve zarf proteinleri ile etkileşime girebilir.
Eğlenceli bir şey olarak, ORF3a’nın yapısı şapka takan bir domuza benziyor. (Karşılaştırın)
ORF6 ayrıca, virüsün sağlıklı hücreleri enfekte etmesine yardımcı olan interferon sinyallerini de durdurur. ORF3’ün aksine, virüs replikasyonunda gerekli olmayan bir oyuncu gibi görünmektedir. Çalışmalar, ORF6’nın hücrede direnç mekanizmaları oluşturmak için gerekli genlerin ifadesi için bir inhibitör olabileceğini de göstermiştir. Şimdiye kadar ORF6’nın atomik yapısı belirlenmemiştir.
ORF7’nin insanlarda COVID-19 enfeksiyonlarının ciddiyetine katkıda bulunabilecek hücre ölümünü indüklediği ileri sürülmüştür. Araştırmalar, aynı zamanda, bir hücrenin, çevredeki hücreleri de enfekte olmak üzere korumak için atılan virionları yüzeyinde tutmak için kullandığı, konak hücrenin tetherin tedarikini sınırladığını ileri sürüyor.
ORF8, yüzeyinde onu bozulmadan koruyan şeker zincirleri (glikozilasyon) taşır. Hem sitoplazmada hem de endoplazmik retikulumda bulunur. Her iki virüste bulunan herhangi bir proteinin SARS-CoV ve SARS-CoV-2 arasındaki en düşük sekans özdeşliğine sahiptir. ORF8’in, bağışıklık sisteminin önemli bir parçası olan enfekte hücrelerin başlıca histokompatibilite kompleks molekülleri ile doğrudan etkileşime girerek MHC-I lizozomal bozulmaya yol açtığına dair kanıtlar olmuştur. Bu, enfekte olmuş hücreleri yok eden sitotoksik T hücresinin sınırlandırılmasına neden olur. Şimdiye kadar ORF8’in atomik yapısı belirlenmemiştir.
Aksesuar protein ORF9b için gen, nükleokapsid geninde alternatif bir açık okuma çerçevesi içinde bulunur. Bu proteinin yapıları şu anda hem SARS-CoV hem de SARS-CoV2 için mevcuttur. Bu proteinin yeni katı, lipitleri bağladığı düşünülen bir oyuk ile hidrofobik arayüze sahip dimerik bir katlanma oluşturur. Zara bağlı olduğu ve virionun birleşmesinde küçük bir yapısal role sahip olabileceği öne sürülmüştür.

Hiç yorum yok:
Yorum Gönder