
Yirmi yıldan kısa bir süre içinde, insanlar için ölümcül üç zoonotik (hayvandan insana geçen) koronavirüs (CoV) orataya çıktı:
- SARS-CoV (şiddetli akut solunum sendromu koronavirüsü), 2002 yılında 1 yıl süren ve yaklaşık 850 kişininin ölümüne sebep olan SARS’a
- MERS-CoV (Orta Doğu solunum sendromu koronavirüsü), 2012 yılında yine 1 yıl süren ve yaklaşık 900 kişinin ölümüne sebep olan MERS’e
- SARS-CoV-2 (şiddetli akut solunum sendromu koronavirüsü-2) 2019’dan bu yana devam eden ve an itibari ile (17 Ekim 2021) 220 milyondan fazla onaylanmış COVID-19 vakası ve 5.5 milyondan fazla COVID-19 ölümüne sebep oldu.
| SARS-CoV-2 | SARS-CoV | MERS-CoV | |
|---|---|---|---|
| cins | Klade I, soy B | Klade I, soy B | Clade II, soy C |
| Nükleotidlerin uzunluğu | 29.9 kilobaz | 29.75 kilobaz | 30.11 kilobaz |
| İlk ortaya çıkış | 7 Aralık 2019, Vuhan, Çin | 16 Kasım 2002, Foshan, Çin | 4 Nisan 2012, Zarqa, Ürdün |
| Virüs tanımlama | Ocak 2020 | Mart 2003 | Haziran 2012 |
| Etken madde beyanı | Ocak 2020 | Nisan 2003 | Eylül 2012 |
| Son durum | Pandemi devam ediyor | tamamen kontrol | sporadik sürekli |
| Enfekte vaka sayısı | *220 milyonun üzerinde | 8096 | 2553 |
| Erkek-kadın oranı | 1.27:1 | 1:1.13 | 1.78:1 |
| Atfedilen ölümlerin sayısı | *5.5 milyondan fazla | 774 | 876 |
| Viral Ayak İzi Sayısı | 213 ülke veya bölge | 29 ülke veya bölge | 27 ülke veya bölge |
| Vaka ölümcül oranı | 4.4% | 9.6% | 34.3% |
Peki, şu andaki pandemiye sebep olan SARS-CoV-2’nin “yüksek patojenik” ve “düşük patojenik” kendi kuzenlerine benzerlikleri ve farklılıkları nelerdir?
Şiddetli akut solunum sendromu koronavirüs 2’nin (SARS-CoV-2) neden olduğu ve hala devam eden COVID-19 pandemisi, 1918’deki H1N1 influenza (İspanyol gribinden) bu yana en yıkıcı salgındır. SARS-CoV-2’nin kökeni bilinmemesine rağmen, 2019 yılının sonunda Çin’in Vuhan kentinde etiyolojisi bilinmeyen bir pnömoni salgını menşeli olduğu kabul edilmektedir.
SARS-CoV-2 hastalığa sebep olan ajan olarak tanımlandı ve genom dizisi kısa süre içinde serbest belirlendi. Çin dışında vakalar arttıkça, Dünya Sağlık Örgütü 11 Mart 2020’de COVID-19’u küresel bir salgın ilan etti (Türkiye’de de ilk vakanın rapor edildiği tarih).
COVID-19 VE DİĞER KORONAVİRÜS HASTALIKLARI
İnsan Coronavirüslerinin Neden Olduğu Hastalıklar
Yedi çeşit insan CoV’si (HCoV) tanımlanmıştır. Bunlar, yüksek derecede patojenik olan üç CoV, SARS-CoV, SARS-CoV-2 ve MERS-CoV ve düşük patojeniteye sahip dört CoV, insan koronavirüsü 229E (HCoV-229E), HCoV-OC43, HCoV-NL63 ve HCoV- içermektedir.
SARS ve MERS
2002-2003 arasındaki SARS salgını ilk olarak Çin’in Guangdong kentinde bildirildi ve diğer ülkelere yayıldı. Salgın, 8.096 onaylanmış vaka ve %9.6’lık bir vaka ölüm oranı ile sona erdi. SARS hastaları pnömoni ve dispneye ilerleyen grip benzeri semptomlar gösterdi ve ciddi vakalarda hayatı tehdit eden akut solunum sıkıntısı sendromu (ARDS) geliştirdiler.
2012’de Orta Doğu’daki ilk MERS salgınından bu yana, Güney Kore’de (2015) ve Suudi Arabistan’da (2018) aralıklı, sporadik vakalarla iki büyük salgın meydana geldi. 15 Ocak 2020 itibariyle, 2.506 onaylanmış MERS vakası vardı ve vaka ölüm oranı ∼ %34’tü. SARS benzeri semptomlara ek olarak, MERS, özellikle 65 yaşından büyük hastalarda ve komorbiditesi olan hastalarda ARDS ve çoklu organ yetmezliğinin daha sık gelişimi ile karakterizedir.
COVID-19
COVID-19’un klinik belirtileri, ateş, öksürük, boğaz ağrısı ve nefes darlığı gibi yaygın semptomlarla SARS’ınkilere benzer. Bununla birlikte, COVID-19’un klinik spektrumu çok daha geniştir, hastaların yaklaşık %80-90’ının hastalığı hafif geçirir. % 10-20’sinin hastaneye kaldırılması gerekir. COVID-19’un vaka ölüm oranı, farklı ülkelerde büyük farklılıklar gösterse de SARS’tan daha düşüktür. COVID-19’un SARS’a benzer hastalık şiddeti yaşla birlikte önemli ölçüde artmaktadır.
COVID-19, kısmen aşağıdaki üç faktörden dolayı SARS’tan çok daha bulaşıcıdır. İlk olarak, kuluçka süresi SARS-CoV-2 için 4-12 gün iken, SARS-CoV için bu değer 2-7 gündür. Ayrıca, COVID-19’da semptomların başlangıcında yüksek bir SARS-CoV-2 viral yükü saptanır ve sonraki hafta hızla azalırken, SARS’ta, SARS-CoV’nin viral yükü semptom başlangıcından 1-2 hafta sonra zirve yapar. Bu nedenle vaka izolasyonu ve temaslı takibi COVID-19 için daha zordur. İkincisi, SARS-CoV-2 ile enfekte olmuş bireylerin büyük bir kısmı asemptomatiktir, presemptomatiktir veya hafif hastalığı vardır, ancak yine de virüsü bulaştırabilirler; ancak SARS-CoV genellikle hastaneye yatış gerektiren ciddi hastalığa neden oldu. Son olarak, viral saçılma da SARS-CoV-2 için SARS-CoV ile karşılaştırıldığında daha uzun sürebilir.
Diğer insan koronavirüslerinin neden olduğu hastalıklar. HCoV-229E, HCoV-NL63, HCoV-OC43 ve HCoV-HKU1, hafif üst solunum yolu hastalığına neden olan ve yetişkinlerde soğuk algınlığının %15-30’una katkıda bulunan düşük patojenik HCoV’lerdir. Ancak bebeklerde, yaşlılarda ve bağışıklığı baskılanmış kişilerde bu düşük patojenik HCoV’ler bazen hayatı tehdit eden bronşiyolit ve pnömoniye neden olur. Küresel olarak yaygın olan bu dört HCoV, özellikle kış aylarında her iki ila üç yılda bir salgınlara neden olur. Enfeksiyon, uzun süreli koruyucu bağışıklık sağlamaz, bu nedenle insanlar tekrar tekrar enfekte olabilir.
Hayvan Coronavirüslerinin Neden Olduğu Hastalıklar
Hayvan koronavirüsleri, birçok evcil ve laboratuvar hayvanı türünün önemli patojenleridir. Fare hepatit virüsü (MHV), dünya çapında fare kolonilerinde bulunur. Laboratuvar farelerinin MHV enfeksiyonu, konak fizyolojisini etkiler ve araştırma denekleri olarak değerlerini tehlikeye atar. Buna karşılık, sırasıyla MHV-3 ve MHV-JHM’nin neden olduğu fulminan hepatit ve kronik demiyelinizasyon, insan hastalıkları için faydalı modeller olarak hizmet etmiştir.
Altı çeşit domuz CoV’sinin hastalıklara neden olduğu bilinmektedir. Bunlar arasında bulaşıcı gastroenterit virüsü (TGEV), esas olarak genç domuz yavrularında ishale neden olur, domuz epidemik diyare virüsü, domuz deltakoronavirus (PDCoV) ve domuz akut diyare sendromu koronavirüsü yenidoğan domuz yavrularında yüksek ölüm oranlarına sahip domuz CoV’leri ortaya çıkarır.
Enfeksiyöz bronşit virüsü (IBV), özellikle genç civcivlerde şiddetli olan akut solunum hastalığına neden olan oldukça bulaşıcı bir CoV’dir ve nefropatojenik varyantlar ortaya çıkmaktadır. Kedileri enfekte eden iki CoV biyotipi mevcuttur: kedi enterik koronavirüsü (FECV) subklinik hastalığa neden olur ve kedi enfeksiyöz peritonit virüsü (FIPV) sistemik ve ölümcül sonuçlara sahiptir.
Tablo 1’de bazı insan ve hayvan CoV’lerini ve neden oldukları hastalıkları özetlenmiştir.
| Konakçı | Koronavirus (türü) | Hastalık(lar) |
| İnsan | SARS-CoV-2 (β) | COVID-19 |
| SARS-CoV (β) | Şiddetli akut solunum sendromu | |
| MERS-CoV (β) | Orta Doğu Solunum Sendromu | |
| HCoV-229E (α) | Nezle, soğuk algınlığı | |
| HCoV-NL63 (α) | Nezle, soğuk algınlığı | |
| HCoV-OC43 (β) | Nezle, soğuk algınlığı | |
| HCoV-HKU1 (β) | Nezle, soğuk algınlığı | |
| Domuz | TGEV (α) | Gastroenterit |
| PRCoV (α) | Hafif solunum yolu hastalığı | |
| PHEV (β) | Kusma ve halsizlik, ensefalomiyelit | |
| PEDV (α) | Gastroenterit | |
| PDCoV (δ) | Gastroenterit | |
| SADS-CoV (β) | Gastroenterit | |
| Fare | MHV (β) | İshal, hepatit, ensefalit |
| Sıçan | SDAV (β) | Sialodakriyoadenit, hafif pnömoni |
| RCoV-P (β) | Ölümcül pnömoni | |
| At | ECoV (β) | Hafif gastrointestinal hastalık |
| İnek | BCoV (β) | Enterit, solunum yolu hastalığı, pnömoni |
| Kedi | FIPV (α) | Peritonit, piyogranülom |
| FECV (α) | Subklinik enterik hastalık | |
| Köpek | CCoV (α) | Enterit |
| CRCoV (β) | Hafif ve şiddetli arasında solunum yolu hastalığı, pnömoni | |
| Tavuk | IBV (γ) | Bronchitis, nephritis |
SARS-CoV-2 VE DİĞER KORONAVİRÜSLERİN MOLEKÜLER VIROLOJİSİ
SARS-CoV-2’nin temel genomik yapısı ve replikasyon döngüsü, diğer CoV’lerinkine benzer ve yapısal ve yapısal olmayan proteinlerinin ana işlevleri de korunur. SARS-CoV-2, SARS-CoV ile aynı reseptörü kullanmasına rağmen, ana virion yüzey proteini olan spike (S) glikoproteinindeki farklılıklar, bağlanma afinitesini ve konak proteazları tarafından parçalanmasında farklılıklar gösterir.

Sınıflandırma ve Evrim
CoV’ler Orthocoronavirinae alt familyasına , Coronaviridae familyasına ve Nidovirales takımına aittir. Bu alt familya dört cinse ayrılmıştır: Alphacoronavirus, Betacoronavirus, Gamacoronavirus ve Deltacoronavirus ve her biri birden çok alt tür içeiri.
Yarasaların alfa ve betakoronavirüsler için rezervuar olduklarına inanılırken, yabani kuşların gama ve deltacorona virüsleri için rezervuar olduklarına inanılmaktadır. SARS-CoV muhtemelen yarasalarda yaygın olan SARS ile ilgili CoV’lerin rekombinasyonu, ara konakçı hurma misk kedisine bulaşması ve son olarak insanlara yayılmasıyla ortaya çıktı. MERS-CoV ayrıca yarasalardan kaynaklanır ve ara konakçı olarak tek hörgüçlü develeri kullanır.
SARS-CoV-2’ye en yakın bilinen akrabası, SARS-CoV-2 ile %96.2 genom dizisi özdeşliğini paylaşan RaTG13 adlı bir yarasa CoV’dir. Bununla birlikte, S proteinindeki ACE-2 bağlanması için kritik olan altı amino asitten sadece biri RaTG13 ile SARS-CoV-2 arasında korunmuştur. Doğrudan progenitörleri 8yani ataları) ve ara konakçıları tanımlanamayan SARS-CoV-2’nin kökeni belirsizliğini koruyor.
Yakın gelecekte, viral iletimi kolaylaştıran ek mutasyonlar (S proteinindeki D614G’ye benzer) muhtemelen ortaya çıkacak ve aşıların yaygın olarak uygulanması da SARS-CoV-2’nin evrimsel yörüngesini etkileyebilecektir. Özellikle, yakın tarihli bir çalışma, SARS-CoV-2’nin insanlar tarafından vizonlara bulaştırıldığını ve insanlara geri bulaştığını göstererek, benzer hayvanların SARS-CoV-2 rezervuarı olma riskini vurgulamıştır.
Morfoloji ve Genomik Yapı
CoV’ler, 80-150 nm çapında, küresel veya pleomorfik zarflı virüslerdir. Virion yüzeyi, S proteini tarafından oluşturulan aynı adı taşıyan taç benzeri (korona Latince taç anlamına gelir) çıkıntıları içerir. CoV genomu, sarmal simetrik bir nükleokapsid olarak zarfın içinde paketlenir. CoV’ler, 27-32 kilobazlık segmentlenmemiş genomlara sahip, pozitif anlamda, tek zincirli RNA virüsleridir (Şekil 1). Genomik RNA, her iki uçta çevrilmemiş bölgelerle çevrili 5′-kaplama ve 3′-poliadenilasyon ile modifiye edilir. Genomun önceki % 70-75’i , replikaz kodlayan açık okuma çerçevesi la ( ORF1a ) ve ORF1b’yi içerirken, kalan bölge yapısal ve aksesuar proteinleri kodlayan ORF’leri içerir.

Coronavirüsler Tarafından Kodlanan Proteinler
CoV’ler bir dizi yapısal, yapısal olmayan ve yardımcı proteini kodlar. Biyokimyasal ve yapısal özelliklerin yanı sıra bu proteinlerin CoV replikasyonu, patogenez ve konak etkileşimlerindeki işlevleri aşağıda kısaca özetlenmiştir.
Yapısal proteinler. CoV’ler dört yapısal proteini kodlar: S, zar (M), zarf (E) ve nükleokapsid (N) proteinleri (şekil 2). MHV, HCoV-HKU1 ve HCoV-OC43’ün hemaglutinin-esterazı ve SARS-CoV’nin ORF3a, 6, 7a, 7b ve 9b’si gibi bazı yardımcı proteinler de olgun viryonlara dahil edilir.
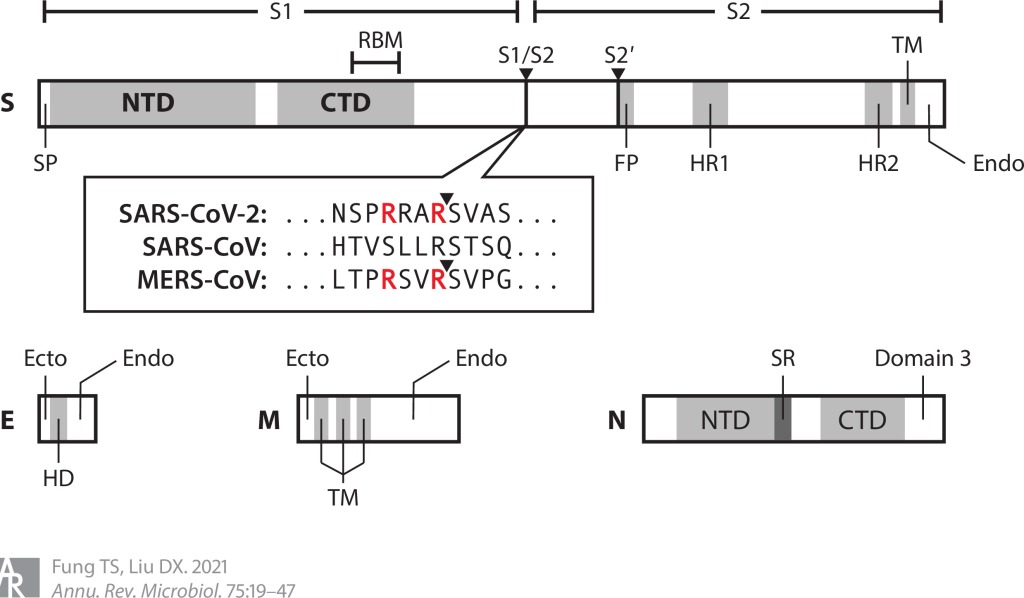
S glikoproteini (150-200 kDa), baskın bir ektodomain ve kısa bir sitozolik kuyruğu olan trimerik bir transmembran proteinidir. Konak proteazları tarafından iki alt birime bölünür. S1 alt birimi, bir N-terminal domeynine (S1-NTD) ve bir C-terminal domeynine (S1-CTD) bölünmüştür. Genel olarak, reseptör bağlayıcı motifler (RBM’ler), protein reseptörleri kullanan CoV’ler için S1-CTD’de ve şeker reseptörleri kullanan CoV’ler için S1-NTD’de bulunur. S2 alt birimi, bazı CoV’lerde ikincil bir proteaz bölünme bölgesinin (S2′) öncesinde gelen füzyon peptidini içerir.
M glikoproteini (23-35 kDa) kısa bir ektodomain (dış tarafa bakan), üç transmembran alanı (TMD’ler) ve bir C-terminal endodomain (iç tarafa bakan) içerir. M proteini en bol bulunan virion proteinidir ve montaj sırasında önemli bir rol oynar. MM monomer etkileşimleri TMD’ler arasında meydana gelirken MM dimer, MS ve MN kontakları M endodomain tarafından yönetilir.
E proteini (8-12 kDa) küçük bir virion bileşenidir ve TMD’sinin pentamerik demetlenmesi bir iyon kanalı (IC) oluşturur. SARS-CoV’de E geninin silinmesi öldürücü değildir, ancak virionlar ciddi şekilde kusurlu olur ve in vivo olarak zayıflatılır. E proteininde IC inaktive edici mutasyonlar ile SARS-CoV’nin virülansı in vivo olarak azalırken, benzer IBV mutantları virion salınımında kusurludur.
N proteininin (43-50 kDa) üç domeyni vardır: NTD ve CTD domeynleri genom ile etkileşime giren temel kalıntılar bakımından zengindir, domeyn 3 ise M proteini ile etkileşime girer. N proteini, replikasyon-transkripsiyon komplekslerine (RTC’ler) alınır ve fosforilasyonu, genom transkripsiyonu sırasında şablon (kalıp) okumasını ve paketleme sırasında RNA bağlanma afinitesini modüle eder.
Son derece değişken S1 alt birimine rağmen, S2 alt birimi ve M, E ve N proteinleri, farklı CoV’ler arasında küçük farklılıklar gözlemlenmesine rağmen, yapı ve işlevler açısından nispeten korunur. Örneğin, M proteininin ektodomaini, çoğu CoV’de N-bağlı glikozile edilir, ancak MHV ve HCoV-OC43 gibi bazı betakoronavirüslerde O-bağlı glikozile edilir. Ayrıca, bazı CoV’lerde (SARS-CoV ve SARS-CoV-2 gibi) E proteininin C terminalinde bir PDZ bağlayıcı motif (PBM) bulunur, ancak diğerlerinde bu yoktur.
Yapısal olmayan proteinler. ORF1a ve ORF1b tarafından kodlanan poliprotein 1a (pp1a) ve pp1ab, 15-16 yapısal olmayan protein (nsps) oluşturmak üzere otoproteolitik olarak bölünür. Bunlar arasında, nsp3’ün papain benzeri proteaz (PLpro) aktivitesi, nsp5’in ana proteaz (Mpro) aktivitesi ve nsp12’nin RNA’ya bağımlı RNA polimeraz (RDRP) aktiviteleri CoV replikasyonunun merkezinde yer alır. Çok domeyli protein nsp3, çeşitli enzimatik aktivitelere sahiptir. Poliproteinlerden PLpro salınan nsp1-nsp3’ün yanı sıra, nsp3 ayrıca sırasıyla ubikuitin ve ISG15’i (interferon ile uyarılan gen 15) hedefleyen deubikitinasyon (DUB) aktivitesine ve de-ISGylation aktivitesine sahiptir. Nsp3’ün makro domeyni, kovalent olarak bağlı ADP-ribozun protein hedeflerinden çıkarılmasını katalize eder. Bu aktiviteler, doğuştan gelen bağışıklık tepkisini antagonize ederek CoV virülansına katkıda bulunur.
Monomerik nsp5, poliproteinlerden salındığında inaktiftir. Nsp5’in homodimerizasyonu, nsp6–nsp16’yı serbest bırakmak için 11 akış-aşağı bölgesini parçalayan aktif Mpro‘yu oluşturur. Son zamanlarda, SARS-CoV Mpro ve MERS-CoV Mpro için katalitik mekanizma bildirildi ve SARS-CoV-2 Mpro‘nun yapısı da çözüldü.
CoV RNA sentezleme düzeneğinin merkezinde, nsp12, nsp7 ve primaz nsp8 ile bir polimeraz kompleksi oluşturmak üzere etkileşime girer, muhtemelen aynı zamanda helikaz nsp13, eksoribonükleaz (ExoN) nsp14 ve diğer viral ve konakçı proteinlerle birleştirilir. SARS-CoV-2 nsp12 ve nsp12-nsp7-nsp8 kompleksinin yapıları, nsp12 N terminalinde yeni bir β-firkete alanı göstererek çözümlenmiştir ve nükleik asitleri barındıran önemli konformasyonel değişiklikler içerir.
Nsp’lerin ana işlevleri CoV’ler arasında yüksek oranda korunmuştur, ancak bazı farklılıklar gözlenmiştir. Örneğin, SARS-CoV, SARS-CoV-2 ve muhtemelen diğer SARS ile ilgili CoV’lerin nsp3’ünde korunmayan bir bölge mevcuttur. Bu isimsiz SARS-benzersiz domeyn (SUD), tüm HCoV’lerin genomlarında bulunan G-dörtlü dizilere bağlanır. SARS-CoV’nin SUD’si ayrıca bir E3 ubiquitin ligazı ile etkileşime girer ve onu kararlı yapar, böylece viral replikasyonu kolaylaştırmak için p53 bozulmasını teşvik eder.
Aksesuar (yardımcı) proteinler
CoV yardımcı proteinleri genellikle in vitro viral replikasyon için vazgeçilmez olarak kabul edilir, ancak bazıları viral patogenezde yer alır. Yakın zamanda SARS-CoV’nin ORF3a ve ORF8b’sinin proinflamatuar sitokinleri indüklediği ve makrofajların kemotaksisini düzenlediği gösterilmiştir. MERS-CoV ve SARS-CoV’nin ORF8b’si ayrıca tip I interferonların (IFN-I) indüksiyonunu da baskılar. Genel olarak, CoV cinsleri arasında homolog yardımcı proteinler yoktur, ancak benzerleri yakından ilişkili CoV’lerde bulunabilir. Örneğin, ORF3a, 6, 7a, 7b ve 9b, SARS-CoV ve SARS-CoV-2 arasında %80’in üzerinde dizi benzerliğine sahiptir.
Çoğalma Döngüleri
Aşağıdaki şekilde SARS-CoV-2 ve diğer CoV’ler arasındaki benzerlikleri ve farklılıkları görüyorsunuz (Şekil 3).

Hücreye yapışma ve giriş
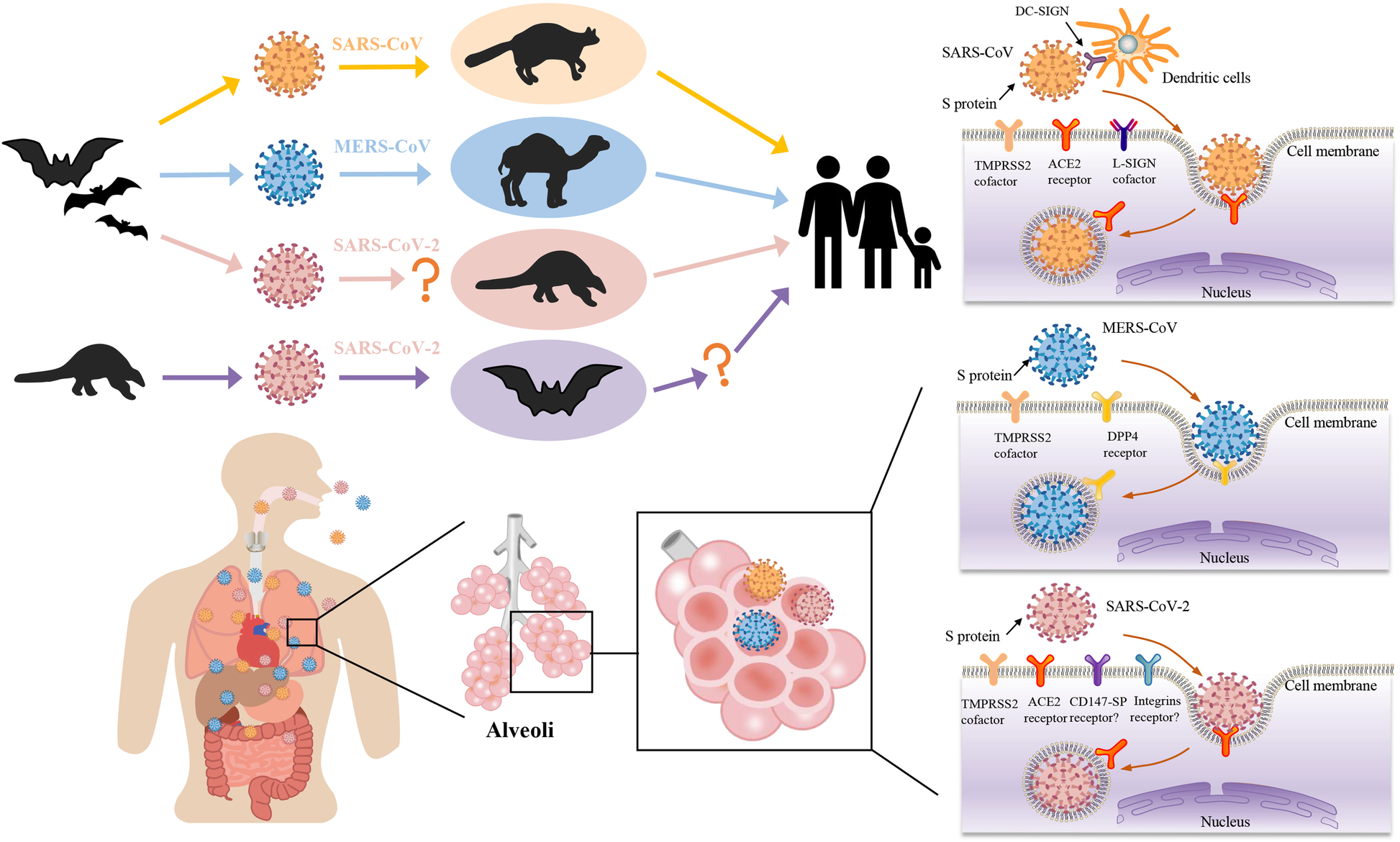
S proteininin aynı kökenli reseptörüne bağlanması CoV replikasyon döngüsünü başlatır. Bazı CoV’ler, SARS-CoV ve SARS-CoV-2 için anjiyotensin dönüştürücü enzim-2 (ACE-2), MERS-CoV için dipeptidil peptidaz-4 ve HCoV-229E için aminopeptidaz N (APN) gibi hücre yüzeyi peptidazlarını reseptör olarak kullanır. Diğer CoV’ler, sialik asit gibi şeker reseptörlerini kullanırken, TGEV S proteini hem APN’ye hem de sialik aside bağlanır. Özellikle, SARS-CoV’nin reseptör bağlama domeyni (RBD) ile karşılaştırıldığında, SARS-CoV-2’nin RBD’si daha büyük ACE-2 bağlanma afinitesine sahiptir ancak daha az maruz kalmaktadır. Ayrıca, SARS-CoV-2 S proteini mutasyonlar geçirmektedir ve doğal mutasyon D614G viral enfektiviteyi artırmaktadır. N-bağlı glikozilasyon ayrıca ACE-2’ye bağlanmasını ve nötralize edici antikorları modüle eder.
Reseptör bağlanmasının yanı sıra, CoV S proteini ayrıca S1/S2 ve S2′ bölünme bölgelerinde konakçı proteolitik aktivasyonu gerektirir. S proteinini parçalayan konakçı proteazları arasında hücre yüzeyi proteazları, lizozomal proteazlar, proprotein dönüştürücüler ve hücre dışı proteazlar bulunur. Bunlar arasında furin, multibazik bir motifi parçalayan bir proprotein dönüştürücüdür. Özellikle, SARS-CoV-2 S proteini, S1/S2 bölgesinde furin tarafından parçalanırken, SARS-CoV S proteininde böyle bir furin bölünme bölgesi yoktur (şekil 2). Furin, tüm dokularda her yerde ifade edildiğinden, SARS-CoV-2 S proteininin bölünmesi, potansiyel olarak geniş doku tropizmine ve arttırılmış bulaşıcılığa katkıda bulunur. Furin dışında, SARS-CoV-2, ACE-2 bağlanmasından kısa bir süre sonra hücre yüzeyi transmembran proteaz serin 2 (TMPRSS2) tarafından da bölünür.
Reseptör bağlanması ve proteaz aktivasyonu, S2 alt birimindeki konformasyonel değişiklikleri tetikler ve membran füzyonu, diğer sınıf I viral füzyon proteinlerinin membran füzyonuna benzer şekilde meydana gelir. CoV tipik olarak geç endozomlara girer ve klatrin bağımlı, caveolar veya diğer endositik yollar yoluyla içselleştirilir.38).
RNA ve protein sentezi
Hücreye girdikten sonra, ORF1a pp1a’ya çevrilirken, programlanmış bir ribozomal çerçeve kayması pp1ab sentezini mümkün kılar. Yukarıda belirtildiği gibi, pp1a ve pp1ab, RTC’yi oluşturmak üzere bir araya gelen nsp’leri oluşturmak için PLpro ve Mpro tarafından işlenir. Diğer virüs kaynaklı yapılarla değil, yalnızca çift zarlı keseciklerle (veziküllerle) ilişkili olan yeni sentezlenen CoV genomik RNA, çift zarlı kesecikten nsp3’ten oluşan gözenekler (porlar) yoluyla dışarıya aktarılır ve sitozoldeki N proteini ile birleşir.
Tam uzunluktaki genomik RNA’yı kopyalamanın yanı sıra, CoV replikaz, transkripsiyonla düzenlenen dizilerdeki şablonlar arasında geçiş yaparak iç içe geçmiş bir dizi subgenomik RNA’ları (sgRNA’lar) sentezler. Ana sgRNA’lara ek olarak, SARS-CoV-2, bilinmeyen ORF’leri füzyon, silme ve çerçeve kaydırma ile kodlayan transkriptler üretir ve viral transkriptler, SARS-CoV-2’nin oldukça karmaşık transkriptom ve epitranskriptomuna işaret ederek çeşitli RNA modifikasyonlarına uğrar.
CoV yapısal ve aksesuar proteinleri, sitoplazmada sgRNA’lardan çevrilir. Betacoronavirus nsp1, konakçı mRNA’ların parçalanmasını teşvik ederek ve translasyonunu inhibe ederek, konakçı gen ifadesini baskılar ve ana virülans faktörü olarak görev yapar. Son yapısal analizler, SARS-CoV-2 nsp1’in ribozomal mRNA giriş tüneline bağlandığını ve onu engellediğini ortaya koymuştur. Özellikle, nsp1/nsp2 bölünme bölgelerinin olmaması nedeniyle, gamakoronavirüsler ve deltakoronavirüsler nsp1 üretmez, ancak benzer konakçı kapanması daha az karakterize edilmiş diğer mekanizmalar tarafından indüklenir.
Montaj ve serbest bırakma
CoV genom paketlemesi en iyi MHV (fare koronavirüsü) için tanımlanmıştır ve diğer CoV’ler için bilgi eksiktir. Nsp15 içindeki 95 nükleotidlik bir kor halka, MHV ve diğer nesil A betacoronavirüsleri için paketleme sinyali olarak hizmet eder. Bu paketleme sinyali, N proteininin ikinci RNA bağlama alanı tarafından tanınır. İlginç bir şekilde, MHV paketleme sinyalinin mutasyonu, genomik RNA paketlemesini ve viral titreleri etkilemez, ancak sgRNA paketlemesinde büyük artışlara ve virüsün in vivo olarak zayıflamasına neden olur.
Paketlenmiş nükleokapsid, endoplazmik retikulum (ER)-Golgi ara bölmesindeki yapısal proteinlerle birleşir ve M proteini CoV partiküllerinin montajını ve morfogenezini düzenler. Çalışmalar, SARS-CoV-2 dahil olmak üzere betakoronavirüslerin biyosentetik salgı yolu yerine lizozomal ekzositoz yoluyla çıkış yaptığını göstermiştir. Diğer CoV’ler düz duvarlı veziküllerde salınır, ancak ayrıntılı mekanizma henüz tam olarak karakterize edilmemiştir.
COVID-19 VE DİĞER KORONAVİRÜS ENFEKSİYONLARININ MOLEKÜLER ÖZELLİKLERİ
CoV’ler, esas olarak S proteinleri tarafından belirlenen spesifik konakçı ve doku tropizmlerine sahiptir. SARS-CoV-2, SARS-CoV ile karşılaştırıldığında doku tropizmini genişletmiştir ve bulaşıcılığı, hafif semptomu olan veya hiç semptom göstermeyen enfekte bireylerin büyük bir oranı nedeniyle kısmen artmıştır. Şiddetli COVID-19’un immünopatogenezi, aşırı sitokin salınımını içeren SARS ve MERS’inkine benzer.
Hücre ve Doku Tropizmi
Reseptörü ve/veya aktive edici proteazları ile birlikte CoV S proteini, doku tropizminin ana belirleyicisidir. CoV’ler tipik olarak solunum yolunu ve/veya gastrointestinal yolu kaplayan epitel hücrelerini enfekte eder, ancak çeşitli doku ve organlara da yayılabilirler. Örneğin, akciğerler en çok etkilenen organlar olsa da, COVID-19 hastalarının ölümünden sonra yapılan otopsilerde farenks, kalp, karaciğer, beyin ve böbreklerde de SARS-CoV-2 tespit edilmiştir. SARS-CoV-2’nin SARS-CoV ile karşılaştırıldığında genişletilmiş doku tropizmi ve zoonotik iletimi, SARS-CoV-2 RBD’lerin daha yüksek ACE-2 bağlanma afinitesi ve S1/S2’deki ek furin bölünme bölgesi ile kısmen açıklanabilir. Ayrıca, ACE-2 ve TMPRSS2 ifade seviyeleri, SARS-CoV-2’nin üst ve alt solunum yolu epitel hücrelerinde daha fazla enfektivitesine paralel olarak burunda en yüksektir ve alt solunum yolu boyunca azalır.
S proteini tarafından reseptör(ler)e spesifik bağlanma da CoV hücre tropizminin ana belirleyicisidir. Elverişli olmayan hücrelerde bir CoV reseptörünün aşırı ifadesi genellikle karşılık gelen CoV’ye izin verir, S proteinindeki (özellikle RBD) mutasyonlar sıklıkla konakçı tropizmindeki değişikliklerle ilişkilidir. Örneğin, insanlardan izole edilen SARS-CoV suşlarının RBM’si, palmiye misk kedilerinden izole edilen suşlarınkinden sadece iki amino asit ile farklılık gösterir, ancak mutasyonlar insan ACE-2’sine olan afiniteyi önemli ölçüde artırır. Bir başka ilginç örnek, sialik asit bağlama aktivitesini ortadan kaldıran S proteininde büyük bir delesyona sahip bir TGEV varyantından ortaya çıkan domuz solunumu CoV’sidir (PRCoV). Sonuç olarak, PRCoV müsin tipi glikoproteinlere bağlanamaz ve bağırsakta enfeksiyon başlatamaz, böylece solunum tropizmine geçiş yapar. Ayrıca, MHV S proteininin ekto bölgesi FIPV’ninki ile değiştirildiğinde, rekombinant virüs kedi hücrelerini enfekte etme kabiliyeti kazanır ve aynı zamanda murin (kemirgen) hücrelerini in vitro enfekte etme kabiliyetini kaybeder. S proteinindeki mutasyonlar ayrıca enterotropik FECV’nin monositler veya makrofajlar için tropizm ile şiddetli FIPV’ye geçişinde de rol oynar.
Aktarma (Transmisyon)
SARS-CoV-2 dahil olmak üzere HCoV’ler, öncelikle öksürme ve hapşırma yoluyla üretilen solunum damlacıkları yoluyla bulaşır (132). Normal konuşma ile oluşan ağızdan sıvı damlacıkları da bulaşmaya katkıda bulunabilir. Biriken kanıtlar ayrıca SARS-CoV-2’nin hava yoluyla taşındığını ve solunan havadaki aerosoller tarafından bulaşabileceğini düşündürmektedir. SARS-CoV-2 bulaşması için diğer potansiyel yollar, kontamine yüzeylerle (fomitler) temas ve fekal (dışkı)-oral (ağız) bulaşmayı içerir. Kediler, köpekler ve yaban gelinciği SARS-CoV-2’ye ve bu evcilleştirilmiş hayvanların COVID-19’un yayılmasındaki potansiyel rolleri araştırılmaktadır.
Temel üreme hızı (R0), toplumda önceden var olan bir bağışıklığın olmadığı varsayılarak, enfekte bir bireyden gelen ortalama ikincil bulaşma sayısı olarak tanımlanır. SARS-CoV-2 için R0, 1.8–3.6, SARS-CoV için 2.0–3.0 arasındadır. Bununla birlikte, SARS-CoV-2 enfeksiyonu asemptomatiktir veya çoğu insanda hafif hastalığa neden olur ve SARS-CoV-2’li kişilerin bulaşıcılığı semptomların başlangıcında veya öncesinde zirve yapar, bu da tek başına vaka izolasyonu yoluyla pandeminin kontrol altına alınmasını imkansız hale getirir. R0 değeri ∼0.69 ve sınırlı aktarılabilirlik ile MERS, sürekli salgınlara neden olmadı, oysa yakın tarihli bir çalışmada HCoV-OC43 ve HCoV-HKU1 için 1.7–2.2 R0 değerleri tahmin edilmektedir. Solunum hastalıklarına neden olan hayvan CoV’leri tipik olarak solunum deşarjları ve/veya aerosoller yoluyla bulaşırken gastrointestinal hastalıklara neden olanlar tipik olarak fekal-oral yolla bulaşır; ancak her ikisi de kontamine yem, su veya fomitlerle yayılabilir.
İmmünopatogenez
COVID-19’un immünopatogenezi, SARS ve MERS’inkine benzer (Şekil 4). Hava yolu epitel hücrelerinin, dendritik hücrelerin (DC’ler) ve makrofajların enfeksiyonu, piroptozun(hücre içi patojenlerle enfeksiyon üzerine ortaya çıkan ve antimikrobiyal yanıtın bir parçasını oluşturan programlanmış litik hücre ölümünün oldukça enflamatuar bir formu) indüklenmesi ile birlikte, patojen ve hasarla ilişkili moleküler modellerin (PAMP’ler ve DAMP’ler) salınmasına ve proenflamatuar sitokinlerin ve kemokinlerin salgılanmasına yol açar. Çoğu durumda, toplanan monositler ve T lenfositler enfeksiyonu temizler ve enfekte olmuş kişi hiçbir semptom göstermez veya hafif hastalıktan sonra iyileşir. Bununla birlikte, bazı hastalarda, özellikle 60 yaşın üzerinde ve komorbiditesi (ikinci bir hastalığı) olanlarda, düzensiz immün yanıtlar, yaygın alveolar hasar, alveolar hücrelerinde pul pul dökülme, hiyalin membran oluşumu ve pulmoner ödem ile karakterize yaygın pnömonite yol açar. Bilgisayarlı tomografi (BT) ile görüntülendiğinde, pulmoner enflamatuar infiltratlar ve ödem buzlu cam opasiteleri olarak görünür. Enflamatuar hücreler tarafından proteazların ve reaktif oksijen türlerinin (ROS) salgılanması, akciğer mikrovasküler bariyerine daha fazla zarar vererek endotel ve epitel hücrelerinin geçirgenliğini arttırır. Sonuç olarak, protein açısından zengin sıvının interstisyel ve hava boşluklarına taşması, bozulmuş oksijen difüzyon kapasitesi ile kendini gösteren ARDS’ye neden olur. Postmortem (ölüm sonrası) inceleme ayrıca alveollerin kalınlaşmasına ve çökmesine neden olan kısmi fibroz ve pnömosit hiperplazisini ortaya çıkarmıştır Hava boşluklarının mononükleer hücrelerle (çoğunlukla lenfositler) sızmasının yanı sıra, otopsi çalışmaları, SARS-CoV-2 ile enfekte olmuş pnömositlerin oluşturduğu çok çekirdekli sinsitiyayı ortaya çıkarmıştır.
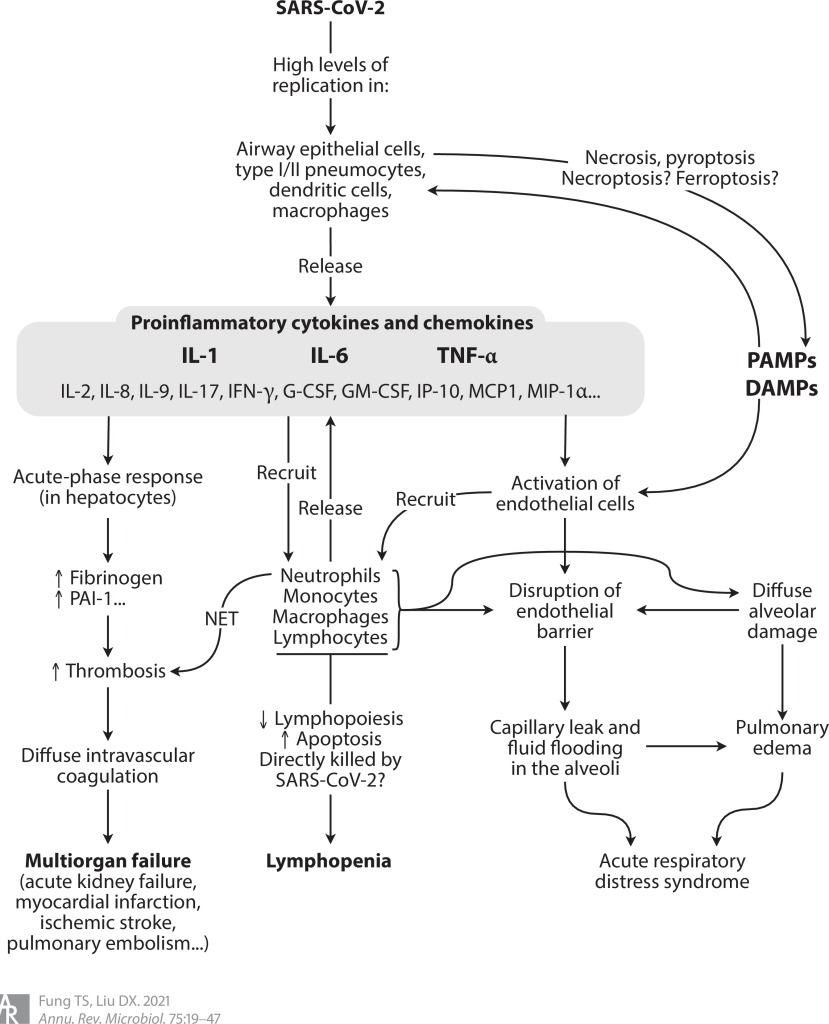
Normalde sitokinlerin yarı ömürleri kısadır ve sadece lenfoid dokulardaki veya iltihaplanma bölgelerindeki hedef hücrelere etki eder. Şiddetli COVID-19 hastalarında proenflamatuar sitokinlerin aşırı ve kontrolsüz salınımı koruyucu eşikleri aşar ve patolojik seviyelere ulaşır. Bu sitokin fırtınası veya sitokin salınım sendromu (CRS), viral sepsis ve çoklu organ yetmezliği gibi yaşamı tehdit eden komplikasyonlara neden olur. COVID-19’un patogenezinde, özellikle interlökin-1 (IL-1), IL-6 ve tümör nekroz faktörü alfa (TNF-α) olmak üzere birden fazla proenflamatuar sitokinin rol aldığı düşünülmektedir. COVID-19 klinik örneklerinin tek hücrede yapılan RNA dizilimi ayrıca kritik durumlarda epitel ve bağışıklık hücreleri arasında çeşitli sitokinler ifade eden enflamatuar makrofajlar ile daha güçlü etkileşimler olduğunu göstermektedir. Bunlar arasında IL-6 ve IL-8, ciddi veya kritik hastalığı olan COVID-19 hastalarında yüksek seviyelerde gözlenir ve bu yüksek IL-6 ve IL-8 seviyeleri, hastalığın ilerlemesini öngören lenfositopeni (kanımızın lenfosit adı verilen yeterli beyaz kan hücresine sahip olmadığı bir bozukluk) ile ilişkilidir.
Şiddetli COVID-19 hastalarında çoklu organ yetmezliğinin merkezinde immünotrombotik düzensizlik vardır. Proenflamatuar sitokinler (özellikle IL-6), hepatositlerde akut faz yanıtını aktive ederek, fibrinojen ve plazminojen aktivatör inhibitörü gibi protrombotik ve antifibrinolitik proteinlerin üretimini arttırır 1. Aktive edilmiş nötrofiller ayrıca trombositler ve fibrin ile daha fazla kümelenen nötrofil hücre dışı tuzakları (NET’ler) serbest bırakır. Ortaya çıkan trombotik komplikasyonlar, akut böbrek yetmezliği ve pulmoner emboli ile beyin ve kalp gibi hayati organlara iskemik hasarı içerir. Gerçekten de, COVID-19’dan ölen birçok kişide yaygın damar içi pıhtılaşma (DIC) gözlenmiştir. COVID-19 otopsi örneklerinin histopatolojisi ayrıca akciğer, böbrek ve kalpte NET içeren inflamatuar mikrovasküler trombüs tespit etmiştir.
Hastanede yatan COVID-19 hastalarının çoğunda lenfopeni tespit edilmiştir ve azalmış CD4 + ve CD8 + T hücre sayımları, hastalığın ilerlemesini göstermektedir. Diğer viral hastalıklarla karşılaştırıldığında COVID-19, daha şiddetli ve kalıcı olan ve T hücre soyları için daha seçici olan lenfopeni ile ilişkilidir. Mekanik olarak, enflamatuar sitokinler aşırı aktivasyonu ve muhtemelen ardından T hücrelerinin tükenmesini teşvik edebilir ve apoptozun indüklenmesi muhtemelen T hücresi tükenmesine katkıda bulunur.
SARS-CoV-2 ile enfekte olan çocukların çoğunda hafif semptomlar olmasına veya hiç olmamasına rağmen, bazılarında yüksek ateş ve Kawasaki hastalığına benzeyen semptomlarla karakterize multisistem inflamatuar sendrom (MIS-C) gelişir: konjonktivit, mukokutanöz döküntü ve koroner arter genişlemesi. Şiddetli MIS-C’li hastalarda ayrıca kardiyovasküler şok, ensefalit ve çoklu organ yetmezliği gelişir. Tam olarak anlaşılmamasına rağmen, MIS-C’nin patogenezi çoklu otoantikorları içerir ve şiddetli COVID-19’dan muzdarip yetişkinlerdeki sitokin fırtınasından farklıdır.
İmmünopatolojiler ayrıca bazı hayvan CoV’lerinin enfeksiyonları ile ilişkilendirilmiştir. Örneğin, nötralize edici olmayan antikorlar tarafından opsonize edilen FIPV virionları, makrofajların ve DC’lerin yüzeyindeki Fc reseptörlerine bağlanır ve bu durum, antikora bağlı ilerlemeye (ADE) neden olur. FIPV ile enfekte olmuş makrofajlar ayrıca lenfositlerin apoptozunu indükler ve IL-10 üretir, bu da T yardımcı tip 2 (Th2)-taraflı koruyucu olmayan bağışıklık tepkisine yol açar. Ayrıca, aktive edilmiş makrofajlar ve T lenfositler, MHV’nin JHM veya A59 suşları ile enfekte olmuş farelerde demiyelinizasyonda rol oynarlar.
COVID-19 VE DİĞER KORONAVİRÜS HASTALIKLARINDA BAĞIŞIK YANIT
Diğer CoV’lere benzer şekilde, SARS-CoV-2, doğuştan gelen bağışıklık tepkisinden kaçınmak, baskılamak veya bozmak için çeşitli mekanizmalar benimseyebilir. Şiddetli COVID-19’un geç evresindeki sağlam bir IFN-I yanıtı, sistemik enflamasyon ve immünopatogenezden sorumlu olabilir. Tipik olarak kısa süreli bağışıklığı indükleyen düşük patojenik HCoV’lerin aksine, SARS-CoV-2, daha uzun bağışıklık belleği ile koruyucu bir antikor ve T hücresi tepkisini indükleyebilir.
Doğuştan Bağışıklık
Doğuştan gelen bağışıklık tepkisi, viral enfeksiyonun ilk tespiti ve kısıtlanması ve ardından adaptif bağışıklık sisteminin aktivasyonu için çok önemlidir. İnterferon üretimi ve aktivitesinin olmaması veya düşük olması ile karakterize edilen oldukça kusurlu bir IFN-I yanıtı, şiddetli COVID-19’lu hastalarda kalıcı viremi (kanda virüs bulunması) ve alevlenmiş bir inflamatuar yanıt ile ilişkilidir. Buna paralel olarak, son çalışmalar, IFN-I bağışıklığının doğuştan gelen kusurlarının ve IFN-I’e karşı otoantikorların indüklenmesinin, yaşamı tehdit eden COVID-19’da rol oynadığını ortaya koymuştur. Özellikle, düşük interferon seviyeleri ve yüksek proinflamatuar sitokin üretimi ile karakterize edilen dengesiz bir konakçı yanıtı, şiddetli COVID-19’un patogenezinin altındaki neden olabilir. Öte yandan, gecikmiş, sağlam bir IFN-I yanıtının hiperenflamasyonu şiddetlendirebileceği ve şiddetli COVID-19’a ilerlemeyi destekleyebileceği de gösterilmiştir.
Tip I ve tip III interferonların indüksiyonu
Doğuştan gelen bağışıklık tepkisi, PAMP (patojenle ilişkili moleküler motifler)’in, yaygın bulunan retinoik asit ile indüklenebilir gen I (RIG-I) benzeri reseptörleri ve bağışıklık hücreleri tarafından ifade edilen endozomal Toll-benzeri reseptörleri (TLR’ler) içeren motif tanıma reseptörlerine (PRR’ler) bağlanmasıyla başlatılır. CoV genomları sitozolde RIG-I ve MDA5 tarafından tanınır, SARS-CoV ve MERS-CoV tarafından interferon indüksiyonu için TLR3, TLR4 ve TLR7 gereklidir. SARS-CoV’nin M proteini de yakın zamanda TLR4 tarafından tanınan bir PAMP olarak tanımlanmıştır. PRR’ler daha sonra adaptör proteinleri ve akış-aşağı yolaklarını aktive ederek NF-κB, interferon düzenleyici faktör 3 (IRF3) ve IRF7 gibi kritik transkripsiyon faktörlerinin indüklenmesiyle sonuçlanır. Bu proteinler sinerjistik olarak IFN-I/IFN-III ve proenflamatuar sitokinlerin transkripsiyonunu indükler.
Replikasyon sırasında, CoV RNA’sı, nsp14’ün guanin-N7-metiltransferaz aktivitesi ve nsp16’nın 2′-O-metiltransferaz ( 2-O-MT) aktivitesi tarafından değiştirilir. 2-O-MT içermeyen CoV’ler, yüksek düzeyde MDA5’e bağlı IFN-I indüksiyonu sergiler ve in vivo olarak zayıflatılır. Ayrıca, nsp15’in endoribonükleaz (EndoU) aktivitesi, MDA5 tarafından tanınan negatif anlamlı RNA’lardaki 5′-poliüridin dizilerini parçalar. PDCoV’nin NS6 proteini, RIG-I/MDA5’in çift zincirli RNA (dsRNA)’sına bağlanır ve bunları zayıflatır.
CoV’ler ayrıca interferon indüksiyonunu baskılamak için çok sayıda mekanizma geliştirmiştir. Örneğin, nsp3’ün deubikuitinasyonu ve de-ISGylation aktiviteleri, doğuştan gelen bağışıklık sinyalinde birçok anahtar faktörü hedefler. SARS-CoV PLpro ile karşılaştırıldığında, SARS-CoV-2 PLpro, ISG15’e karşı daha yüksek afiniteye ve özgüllüğe sahiptir ve IFN-I indüksiyonunu azaltmak için IRF3’ün de-ISGilasyonuna aracılık eder. Anahtar transkripsiyon faktörlerinin nükleer translokasyonu ve aktivitesi, SARS-CoV’nin N proteini, ORF3b ve ORF6’sı ve MERS-CoV’nin M proteini, N proteini, ORF4a, ORF4b, ORF5 ve ORF8b tarafından da inhibe edilir.
İnterferon sinyali ve antiviral interferon ile uyarılan genler
Çevrilmiş (translasle edilmiş) IFN-I (IFN-a/β/ε/κ/ω) ve IFN-III (IFN-λ) serbest bırakılır ve otokrin/parakrin bir şekilde reseptörlere bağlanır. IFN-I reseptörü (IFNAR) her yerde ifade edilirken, IFN-III reseptörü (IFNLR) esas olarak epitel hücreleri ve miyeloid hücrelerde ifade edilir. İnterferonların reseptörlere bağlanması, Janus kinaz (JAK)/sinyal ileticilerinive transkripsiyon (STAT) yolunun aktivatörlerini aktive eder ve ISG’lerin ifadesini indükler. ISG’ler, antiviral proteinleri ve doğuştan gelen bağışıklığın düzenleyicilerini içerir ve mekanizmalarının çoğu tam olarak karakterize edilmemiştir.
Kültürle alınmış epitel hücre hatlarında, IFN-I ve IFN-III, SARS-CoV-2 replikasyonunu doza bağlı bir şekilde inhibe ederken, SARS-CoV replikasyonu sadece IFN-α ile sınırlandırılır, SARS-CoV’nin SARS-CoV-2 tarafından paylaşılmayan ek interferon-antagonistik mekanizmalar geliştirmiş olabileceğini düşündürmektedir. Bununla birlikte, muhtemelen STAT1 fosforilasyonunun inhibisyonu nedeniyle, SARS-CoV-2 ile enfekte olmuş DC’lerde interferon indüksiyonu zayıflar. Özellikle, alfa ve betakoronavirüslerin nsp1’i ve IBV’nin ORF5b’si, interferon proteinlerinin üretimini sınırlamak için konak translasyon kapatmasını indükler. Diğer mekanizmalar, nükleer translokasyonun inhibe edilmesini ve STAT proteinlerinin bozulmasını teşvik etmeyi içerir.
Oligoadenilat sentetaz (OAS) ve latent endoribonükleaz (RNaseL) nispeten iyi bilinen ISG’lerdir. OAS, dsRNA tarafından aktive edilir ve RNaseL’yi aktive etmek için ikinci bir haberci olan 2′-5′-oligoadenilat sentezler. Aktive edilmiş RNaseL, viral replikasyonu kısıtlamak için konakçı ve viral RNA’yı ayrım gözetmeksizin böler. Özellikle, MHV’nin yardımcı proteini NS2 ve MERS-CoV’nin ORF4b proteini, 2′,5′-oligoadenilat’ı bozan ve OAS-RNaseL’nin antiviral etkisine karşı koyan 2′,5′-fosfodiesteraz aktivitesi sergiler.
Bazı CoV reseptörleri ve giriş faktörleri gerçekten de ISG’lerdir. Örneğin, SARS-CoV-2 reseptörü ACE-2 bir insan ISG’sidir, bu da SARS-CoV-2’nin kendi enfeksiyonunu kolaylaştırmak için ACE-2’yi yukarı regüle etmek için konakçı interferon sinyalinden yararlandığını düşündürür. Ayrıca, interferonla indüklenebilir transmembran (IFITM) proteinleri tipik olarak SARS-CoV ve MERS-CoV girişini engellerken, aslında HCoV-OC43 için giriş faktörleri olarak hizmet ederler.
Proinflamatuar sitokinlerin indüksiyonu ve sinyalizasyonu
Makrofajlarda ve DC’lerde CoV enfeksiyonu ayrıca IL-6 ve TNF-a gibi proinflamatuar sitokinlerin salgılanmasını da indükler. İnterferonların indüklenmesine benzer şekilde, bu sitokinlerin indüksiyonu, NF-KB gibi anahtar transkripsiyon faktörleri tarafından yönetilir. Ek olarak, IL-6’nın transkripsiyonu, IFN-JAK/STAT yolunun aşağısındaki IRF1 tarafından ve IL-1 ve TNF-α dahil olmak üzere diğer proinflamatuar sitokinler tarafından da aktive edilir. Özellikle, rekombinant SARS-CoV S proteini, makrofajlarda IL-6 ve TNF-α’yı NF-κB’ye bağlı bir şekilde uyarır, bu da reseptör bağlanmasının sitokin indüksiyonuna katkıda bulunduğunu düşündürür.
IL-6, bağışıklık hücreleri üzerindeki membran IL-6 reseptörüne (mIL-6R) bağlanır ve B hücrelerinin plazma hücrelerine farklılaşması ve CD4 + T hücrelerinin ve foliküler T yardımcı (Tfh) hücrelerinin farklılaşması gibi pleiotropik (özel eylem dışındaki eylemler) etkilere neden olur. Ek olarak, plazmadaki yüksek konsantrasyonlarda IL-6, çözünür IL-6 reseptörüne (sIL-6R) bağlanır ve potansiyel olarak tüm hücre yüzeylerinde bir sinyal kompleksi oluşturmak için gp130’u bağlar. Bu trans-sinyalleme şiddetli COVID-19’dan muzdarip hastalarda CRS giden, diğer proenflematuar sitokinleri ve aşırı ilave IL-6 salınımını tetikleyebilir.
Membranla ilişkili bir sitokin olarak üretilen TNF-α, TNF-α-dönüştürücü enzim (TACE) tarafından bölünebilir ve çözünür bir sitokin olarak salınabilir. Lokalize TNF-α, vasküler geçirgenliği arttırır ve monositlerin ve nötrofillerin ekstravazasyonunu (intravenöz uygulamalarda ilaçların istemeden perivasküler ya da subkutan boşluğa verilmesi ya da bu boşluğa sızmasını) kolaylaştırırken, TNF-α’nın sistemik salınımı kanın pıhtılaşmasını tetikleyebilir ve DIC’ye yol açabilir. SARS-CoV S proteininin ACE2’ye bağlanması, TNF-α’nın bölünmesini ve salınımını artıran TACE’yi aktive eder. Şiddetli COVID-19 hastalarında benzer mekanizmaların aşırı TNF-α düzeyine yol açması mümkündür.
Adaptif Bağışıklık Tepkisi
Yapılan bir ilk çalışmada, semptomların başlamasından sonraki 19 gün içinde COVID-19 hastalarında antiviral IgG tespit edilmiştir. Şiddetli COVID-19 hastalarında antikor yanıtlarının büyüklüğü ve dayanıklılığı daha fazladır, ancak asemptomatik enfekte kişiler ve hafif hastalığı olanlar bile SARS-CoV-2’ye özgü antikorlara sahiptir. SARS-CoV-2 enfeksiyonu, RBD bağlanması için ACE-2 ile rekabet eden ve böylece viral girişi bloke eden güçlü nötralize edici antikorları indükler.
Bununla birlikte, bazı çalışmalar, SARS-CoV-2’ye karşı hümoral (antikor) bağışıklığın genellikle kısa ömürlü olduğunu ve çoğu SARS-CoV-2 antikorunun düşük seviyelerde somatik hipermutasyon sergilediğini göstermektedir ve bu muhtemelen kısmen germinal merkez (GC) yanıtlarının eksikliğinden kaynaklanabilir. GC’ler, antijenle (yani virüsle) aktive olan B hücrelerinin, Tfh hücrelerinin yardımıyla bellek B hücrelerine veya uzun ömürlü plazma hücrelerine farklılaştığı ikincil lenfoid organlardaki geçici yapılardır. Aşırı TNF-α, şiddetli COVID-19 hastalarında Tfh hücre farklılaşmasını ve GC yanıtlarının oluşumunu baskılayabilir, ancak aynı şeyin daha hafif COVID-19 enfeksiyonları için geçerli olup olmadığı bilinmemektedir. Bununla birlikte, yakın tarihli bir çalışma, SARS-CoV-2’ye karşı antiviral antikorların tanıdan sonraki dört ay içinde azalmadığını göstermektedir ve iyileşen hastalarda SARS-CoV-2’nin yeniden enfeksiyonu nadir görünmektedir.
T hücre aracılı lenfopeniye ek olarak, COVID-19 hastalarında hem CD8 + hem de CD4 + T hücrelerinde aktivasyon ve/veya tükenme belirteçlerinin ifadesinde artış gözlenir ve bu, potansiyel olarak ciddi hastalıkla ilişkili optimalin altında veya uygunsuz T hücresi yanıtlarına katkıda bulunur. Özellikle, SARS-CoV-2, asemptomatik bireyler ve saptanamayan antikor yanıtları olanlar için bile çoğu nekahat dönemindeki bireylerde güçlü bellek T hücre yanıtlarını indükler, ancak bu T hücrelerinin gelecekteki yeniden enfeksiyona karşı koruma sağlayıp sağlamadığı henüz belirlenmemiştir. Ayrıca, önceden var olan SARS-CoV-2-reaktif CD4 + T hücreleri, maruz kalmayan sağlıklı donörlerin %35’inde tespit edilmiştir ve muhtemelen endemik soğuk algınlığı CoV’lerle geçmişteki karşılaşmalar sırasında oluşturulmuştur. Bu çapraz reaktif T hücre hafızası, COVID-19’da gözlemlenen kapsamlı heterojenliği kısmen açıklayabilir.
KORONAVİRÜS-KONAKÇI ETKİLEŞİMİ
CoV’lerin replikasyonu, konakçı faktörleri kendi lehine kullanır ve önemli sinyal yolaklarını aktive eder. SARS-CoV-2 ve diğer CoV’ler tarafından programlanmış hücre ölümünün (PCD) indüklenmesi immünopatogeneze katkıda bulunabilir. Bir hücresel stres yanıtının aktivasyonu, CoV replikasyonunu ve immün yanıtın indüklenmesini de düzenleyebilir.
Programlanmış hücre ölümü
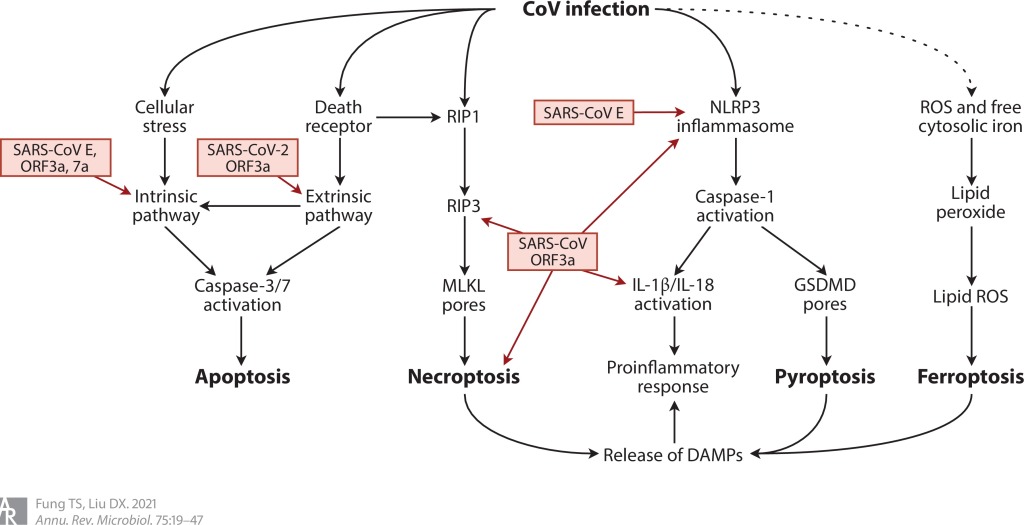
Dört tip PCD tanımlanmıştır: apoptoz, piroptoz, nekroptoz ve ferroptoz. Burada, CoV enfeksiyonu bağlamında PCD’nin sinyal yolalarını ve sonuçlarını kısaca gözden geçirilmiştir (Şekil 5).
Apoptoz
Apoptoz, hücresel streslere yanıt olarak B hücre lenfoma 2 (Bcl2) ailesi proteinleri tarafından yönetilen içsel (intrinsik) yolak veya hücre yüzeyindeki ölüm reseptörleri tarafından başlatılan dışsal (ekstrinsik) yolak tarafından aktive edilebilen yüksek düzeyde düzenlenmiş, enflamatuar olmayan bir PCD formudur. Her iki yol da icracı kaspaz-3/7’nin aktivasyonunda birleşirler.
Apoptoz, CoV hastalıklarının patogenezinde yer almıştır. Örneğin, MERS-CoV enfeksiyonu, akciğer ve böbrek hasarına katkıda bulunan apoptoza aracılık eden dekapentaplejik protein 7 (Smad7) ve fibroblast büyüme faktörü 2’ye (FGF2) karşı yukarı regüle eder. Apoptoz, CoV ile enfekte olmuş bağışıklık hücrelerinde de indüklenir. MERS-CoV, hem dışsal hem de içsel yolakları aktive ederek insan birincil T lenfositlerini verimli bir şekilde enfekte eder. Ayrıca, MHV3 ile indüklenen fulminan hepatitli farelerde, B ve T lenfosit zayıflatıcısının (BTLA) silinmesi, MHV3 ile enfekte olmuş makrofajların hızlı apoptozisi ile sonuçlanır, bu da karaciğer hasarını hafifletir ve mortaliteyi azaltır.
Son zamanlarda, SARS-CoV-2’nin ORF3a’sının aşırı ifadesinin, ekstrinsik apoptotik yolağı aktive ettiği bulundu. SARS-CoV-2’nin ORF3a’sı, SARS-CoV ile %73 amino asit homolojisi paylaşır ve potasyum iyon kanalı aktivitesi için gerekli olan Cys133 de korunur. Diğer çalışmalar, ORF3a’nın silinmesinin SARS-CoV enfeksiyonunun neden olduğu hücre ölümünü azalttığını göstermiştir. Apoptozun şiddetli COVID-19 hastalarında lenfopeniye katkıda bulunan ana mekanizma olup olmadığı henüz doğrulanmadı.
Piroptoz
Piroptoz, esas olarak bağışıklık hücrelerinde aktive olan yüksek oranda proinflamatuar bir PCD’dir. NOD-, LRR- ve pirin alanı içeren protein 3 (NLRP3) inflamasyonunun aracılık ettiği piroptoz, iki sinyal gerektirir (134). Sitokinler ve PAMP’ler, inflamatuar bileşenlerin ve IL-1β/IL-18’in transkripsiyonunu indükleyen sinyal 1’i sağlar. Daha sonra çeşitli PAMP’ler ve DAMP’ler, NLRP3 iltihaplanmasını aktive eden sinyal 2’yi sağlar. Aktive edilmiş kaspaz-1, gasdermin D’yi parçalayarak plazma zarı üzerinde geçirgen gözenekler oluşturmasını sağlar. Aktive edilmiş kaspaz-1, bu proinflamatuar sitokinlerin salınımını kolaylaştırmak için IL-1β/IL-18’i de parçalar.
Şiddetli COVID-19 hastalarında artan kaspaz-1 aktivitesi ve önemli ölçüde yükselmiş IL-1β ve IL-18 seviyeleri tespit edilir ve T hücresi tükenmesine ve SARS-CoV-2 immünopatogenezine katkıda bulunabilir. Özellikle, MHV3 enfeksiyonunun neden olduğu fulminan hepatit, NLRP3 veya kaspaz-1 nakavt farelerde iyileşir ve MHV3 patogenezinde NLRP3 ve kaspaz-1’in rollerini vurgular. İlginç bir şekilde, NLRP3 aracılı inflamasyon, MERS-CoV ile enfekte olmuş yarasa hücrelerinde azdır, bu da yarasaların MERS-CoV ve diğer zoonotik virüsler için doğal bir rezervuar olarak nasıl hizmet ettiğini kısmen açıklar.
SARS-CoV’nin E proteini ve ORF3a piroptoz indüksiyonunda rol oynar. Kalsiyum kanalı görevi gören SARS-CoV E proteini, VeroE6 hücrelerinde NLRP3 inflamasyonunu aktive eder ve bir fare modelinde IL-1β ekspresyonuna ve inflamatuar akciğer hasarına katkıda bulunur (100). SARS-CoV ORF3a, potasyum akışını ve mitokondriyal ROS üretimini düzenleyerek lipopolisakkarit ile hazırlanmış makrofajlarda IL-1β salgılanmasını uyarır. Mekanik olarak, ORF3a, pro-IL-1β’nin (sinyal 1) transkripsiyonunu indüklemek için NF-κB/p105’in her yerde bulunmasını ve aktivasyonunu desteklemekle kalmaz, aynı zamanda NLRP3 inflamatuarının (sinyal 2) montajını da kolaylaştırır.
Nekroptoz ve ferroptoz
Nekroptoz, ölüm reseptörleri ve reseptör etkileşimli protein 1 (RIP1)-RIP3-karışık soy (leneage) kinaz domeyni benzeri protein (MLKL) fosforilasyon kaskadı tarafından aktive edilir. Oligomerize MLKL daha sonra plazma zarında parçalayıcı gözenekler oluşturarak litik hücre ölümüne ve DAMP’lerin salınmasına yol açar. Bir HCoV-OC43 nörovirülent mutantının enfeksiyonu, nöronal hücrelerde nekroptozu indükler, ancak apoptozu indüklemez. SARS-CoV ORF3a’nın aşırı ifadesi ayrıca RIP3’e bağımlı ancak MLKL’den bağımsız nekroptotik hücre ölümünü indükler. Özellikle, karaciğer parankimal hücrelerinde RIP1’i silinmiş fareler, MHV3 enfeksiyonunun neden olduğu daha şiddetli fulminan hepatit geliştirir. RIP1’in hepatositleri makrofajlar tarafından salgılanan TNF-α’nın neden olduğu hasardan koruduğu öne sürülmüştür.
Ferroptoz, demir ve ROS’a bağımlı bir PCD formudur. Antioksidan glutatyon tükendiğinde, glutatyon peroksidaz 4 baskılanır ve sitotoksik lipid peroksitler birikir. Serbest sitozolik demir varlığında, lipid peroksitler lipid ROS’lara dönüştürülür, bu da membran yırtılmasına ve DAMP’lerin salınmasına yol açar. CoV enfeksiyonu ile ilişkili bir ferroptoz raporu yoktur. Bununla birlikte, şiddetli COVID-19’lu bazı hastalarda hiperferritinemi ve değişmiş demir homeostazı, viral patogenezde ferroptoz spekülasyonlarına yol açmıştır.
Hücresel Stres Tepkisi
Çok sayıda CoV’li enfeksiyonlar, katlanmamış protein yanıtının (UPR) üç dalını aktive eder: PERK [protein kinaz R (PKR) benzeri ER protein kinaz], IRE1 (inositol gerektiren enzim 1) ve ATF6 (transkripsiyon faktörü 6)’yı aktive eder. CoV replikasyonunu önemli ölçüde etkilemese de, UPR, CoV enfeksiyonu sırasında otofaji, apoptoz ve doğuştan gelen bağışıklığın düzenlenmesinde rol oynar.
Entegre stres yanıtı sırasında, eIF2a’nın PERK, PKR ve ilgili kinazlar tarafından fosforilasyonu, global protein translasyonunu bastırır. PERK, PKR ve eIF2α, SARS-CoV veya IBV ile enfekte olmuş hücrelerde aktive edilir. TGEV ile enfekte olmuş hücrelerde, PERK ve eIF2α aracılı translasyonel zayıflama, NF-κB inhibitörü α seviyesini azalttı, böylece TGEV replikasyonunu baskılayan NF-κB’ye bağlı IFN-I üretimini aktive etmiştir.
Bazı CoV’lerle enfeksiyon, translasyon yapmayan haberci ribonükleoproteinler tarafından birleştirilen sitoplazmik membrana bağlı olmayan kompartmanlar olan stres granüllerinin (SG’ler) oluşumunu indükler. TGEV enfeksiyonu sırasında, polipirimidin bağlayıcı protein, viral RNA’larla birleşir ve viral gen ekspresyonunu düzenlemek için onları SG’lere yeniden konumlandırır. Buna karşılık, IBV genomik RNA’sı SG’lere yönlendirilmez ve IBV ile indüklenen SG oluşumu, eIF2α’ya bağlı çeviri kapatmasından ayrılır. Son olarak, MERS-CoV’nin ORF4a’sı dsRNA’ya bağlanır ve PKR aktivasyonunu baskılar, böylece translasyon inhibisyonunu kurtarır ve SG oluşumunu önler.
CoV enfeksiyonu ayrıca, de novo protein sentezi olmaksızın uyarılma üzerine hemen aktive olan genler olan yakın-erken genleri (IEG’ler) indükler. Örneğin, erken büyüme yanıtı proteini 1 ( EGR1 ), cJUN ve cFOS , proenflamatuar sitokinlerin transkripsiyonunu aktive eden IEG’lerdir. Buna karşılık, HCoV-229E enfeksiyonu, NF-κB’ye bağlı sitokin üretimini baskılayan TNF-α ile indüklenen protein 3’ü indükler.
TANI, TEDAVİ VE ÖNLEME
Proteazları ve RDRP’yi hedef alan geniş spektrumlu inhibitörler, SARS-CoV-2 ve diğer CoV’lere karşı umut verici antiviral etkiler göstermiştir. Bu arada, farklı teknoloji platformlarını kullanan COVID-19 aşıları, umut verici sonuçlarla geliştirilmekte veya klinik olarak test edilmektedir. Bu yazının yazıldığı tarihte COVID-19 için inaktif aşılar, mRNA aşıları ve adenovirüs bazlı aşılar milyonlarca insana yapılmakt idi.
Teşhis
COVID-19 için en güvenilir test, SARS-CoV-2’nin genomik RNA’sını tespit eden ters transkripsiyon polimeraz zincir reaksiyonudur (RT-PCR). Antikor testleri geçmiş enfeksiyonu tespit eder ve enfeksiyonun erken evresinde etkili olmayabilir, ancak bir popülasyonda serolojik sürveyans için değerli olabilirler. Antijen testleri, SARS-CoV-2 proteinlerini tespit eder ve RT-PCR’den daha az hassastır, ancak en bulaşıcı bireyleri hızla tanımlamak için kullanılabilirler.
Antiviraller
CoV’lere karşı antiviraller esas olarak viral proteazları veya RdRp’yi hedefler.
Proteaz inhibitörleri
Hem PLpro hem de Mpro, CoV’lere karşı antiviraller için umut verici hedeflerdir. Yapı yönlendirmeli tasarımı kullanan bir çalışma, homolog insan DUB enzimleri üzerinde nanomolar miktarlarda ve yüksek seçiciliğe sahip PLpro inhibitörlerini tanımlamıştır. CoV Mpro inhibitörleri de yakın zamanda tasarlandı ve birincil hava yolu epitel hücrelerinde SARS-CoV-2’ye karşı antiviral etkiler gösterdi ve MERS-CoV ile enfekte olmuş farelerde hayatta kalma oranlarını iyileştirdi. Spesifik bir CoV proteaz inhibitörü onaylanmamış olmasına rağmen, HIV proteaz inhibitörleri lopinavir ve ritonavir kombinasyonu COVID-19 hastalarında test edilmiştir; ancak, etkinliği hala belirsizdir.RDRP inhibitörleri. CoV RDRP, COVID-19 hastalarında IFN-β ve proteaz inhibitörleri ile kombinasyon halinde test edilmiş olan ribavirin gibi klasik nükleosit analogları tarafından inhibe edilebilir. Nükleotid ön ilacı remdesivir ayrıca hücre kültüründe geniş spektrumlu anti-CoV aktivitesi sergiler ve bir SARS-CoV fare modelinde hastalık şiddetini hafifletir. Remdesivir, CoV RDRP tarafından bir substrat olarak tanınır ve kovalent olarak dahil edilir, bu da gecikmiş bir zincir sonlandırmasına neden olur. Erken bir deneme, remdesivir’in şiddetli COVID-19 hastalarında iyileşme süresini kısalttığını, ancak mortalite üzerinde önemli bir etkisi olmadığını gösterdi.
Özellikle, CoV nsp14 ExoN, remdesivir ve diğer nükleozid analoglarının etkinliğini önemli ölçüde azaltan düzeltme okuma etkinliği sergiler. Β- adı verilen yeni bir nükleotid analogu d-N4-hydroxycytidine (NHC) son zamanlarda geliştirilmiştir. NHC’nin inhibe edici etkisi, ExoN aktivitesi olmayan MHV’de ve vahşi tip MHV’de karşılaştırılabilirdi, bu da NHC’nin CoV ExoN aktivitesinden kaçabileceğini veya üstesinden gelebileceğini düşündürdü. NHC ayrıca hücre kültüründe ve SARS-CoV ve MERS-CoV fare modellerinde umut verici antiviral aktiviteye sahiptir. COVID-19 ve diğer CoV hastalıklarının tedavisinde RDRP inhibitörlerinin etkinliğini doğrulamak için daha büyük ölçekli randomize çalışmaların yapılması garanti edilmektedir.
Diğer Terapötik Müdahaleler
COVID-19 hastalarında antivirallerin yanı sıra çeşitli terapötik müdahaleler de denenmiştir. Özellikle, yaygın olarak kullanılan steroid deksametazon, kritik COVID-19’lu hastaların ölüm oranını önemli ölçüde azaltır. İyileşmiş COVID-19 hastalarından alınan yüksek nötralize edici antikor titrelerine sahip nekahat plazmasının transfüzyonu da bazı çalışmalarda umut verici sonuçlar elde etmiştir. Buna karşılık, hidroksiklorokin, artan advers olay riski ile ilişkilendirilmiştir ve son çalışmalar, insan akciğer hücrelerinin SARS-CoV-2 ile enfeksiyonunu engellemediğini de göstermektedir.
SARS-CoV-2’nin RBD’sini hedefleyen nötralize edici monoklonal antikorlar (mAb’ler), hayvan modellerinde ve erken denemelerde umut verici terapötik potansiyel göstermiştir. RBD’nin farklı bölgelerini hedefleyen bir mAb kokteyli, virüsün mutasyonel kaçış riskini azaltabilir ve ultrapotent mAb’ler, S proteinini kapalı bir konformasyonda kilitlemek de dahil olmak üzere birden fazla mekanizma ile SARS-CoV-2 bağlanmasını bloke eder. Ayrıca IL-6, IL-6 reseptörüne veya diğer proinflamatuar sitokinlere (IL-1 ve TNF-α) karşı mAb’ler, şiddetli COVID-19 hastalarında KRS’yi azaltmak için kullanılmıştır.
Aşılar
SARS-CoV-2 aşılarının devam eden geliştirme ve dağıtımı, bu makalenin kapsamı dışında kalan tartışmalı konulardır. Burada, SARS-CoV-2 için aşı geliştirmek için benimsenen teorik temellere ve farklı yaklaşımlara odaklanıyoruz.
İnaktive aşılara ek olarak, SARS-CoV-2 için aşı adaylarının çoğu, reseptör bağlanması ve viral girişteki temel rolü nedeniyle S proteinini hedefler. S2 alt birimine iki prolin eklenmesi, S1/S2 furin bölünme bölgesinin mutasyonu, sitoplazmik kuyruğun silinmesi ve C terminaline trimerizasyon etiketi eklenmesi gibi modifikasyonlar protein stabilitesini ve/veya antikor titrelerini nötralize edebilir. S’ye özgü nötralize edici antikorların birincil hedefi olarak, SARS-CoV-2’nin RBD’si de bir immünojen olarak kullanılır.
SARS ve MERS için aşı adayları geliştirildi, ancak klinik öncesi aşamada sonlandırıldı. Halihazırda, IBV ve PEDV dahil olmak üzere hayvan CoV’lerinin neden olduğu hastalıklar, esas olarak canlı zayıflatılmış ve inaktive aşılar tarafından kontrol edilmektedir, ancak ortaya çıkan varyantlar klasik aşıların etkinliğini azaltmıştır. COVID-19 için aşı adayları, çeşitli teknoloji platformlarına dayalı olarak geliştirilmektedir. Bunlar arasında, yeni mRNA aşılarının üretimi nispeten kolay ve hızlıdır ve erken denemelerde bazı umut verici sonuçlar elde edilmiştir.
Önceki çalışmalar, SARS ve MERS için bazı aşı adaylarının, nötrleştirici olmayan antikorların üretimi ve eozinofil infiltrasyonuna ve yüksek derecede inflamatuara yol açan bir Th2 hücresel tepkisi ile karakterize edilen, aşıyla güçlendirilmiş hastalık adı verilen bir süreçte ilgili virüsle tehdit edilen farelerdeki hastalıkları iyileştirdiğini ileri sürdü. akciğer lezyonları. Spesifik olarak, sınırlı veya nötrleştirici aktiviteye sahip düşük afiniteli antikorlar, antikorların Fc kısımlarının immün hücrelere ve/veya kompleman proteinlerine bağlanmasının hastalığı alevlendirdiği ADE ile ilişkilendirilmiştir. Cesaret verici bir şekilde, üç SARS-CoV-2 aşı adayının erken denemeleri, bağışıklamanın nötralize edici antikorları ve bir Th1 hücresel tepkisini uyardığını göstermektedir.
ÇÖZÜM
Etkili aşıların dağıtımı, sağlayabileceği koruma konusunda belirsizlikler olsa da, COVID-19 pandemisini durdurmak için son derece önemlidir. SARS-CoV-2 S proteini, RDRP ve proteazların ve diğer potansiyel olarak ilaç alınabilir proteinlerin hızlı ve ayrıntılı yapısal karakterizasyonları ile güçlendirilen antiviral taramalar, benzeri görülmemiş bir ölçekte ve hızda ilerlemektedir. Dünya çapındaki araştırmacılar, COVID-19 hastaları ve çok sayıda model sistem için son teknoloji multi-omik yaklaşımları kullanarak, SARS-CoV-2 replikasyonu ve patogenezinin moleküler temelini ve bunun ortaya çıkardığı çeşitli bağışıklık tepkisini ortaya koyuyor.
Hayvan CoV’leri üzerine araştırmalar da faydalı ve önemlidir. İlk olarak, yüksek derecede patojenik olan üç HCoV’nin tümü zoonotiktir, bu nedenle vahşi ve evcil hayvanlardaki CoV enfeksiyonlarının daha iyi anlaşılması, onların evrimsel yörüngelerini tahmin etmemize ve gelecekteki salgınlara hazırlanmamıza olanak sağlayacaktır. İkincisi, prototipik hayvan CoV’leri on yıllardır kapsamlı bir şekilde incelenmiştir ve replikasyon ve patogenez mekanizmalarının çoğu korunur ve HCoV’lere tahmin edilebilir. Son olarak, bazı hayvan CoV hastalıkları çiftçilik endüstrisine önemli yükler getirir, bu nedenle bunların önlenmesi ve kontrolü, özellikle pandemi nedeniyle üretimin azaldığı bir dönemde küresel gıda güvenliği için çok önemlidir.
Bir diğer acil soru ise bir sonraki zoonotik HCoV’nin nasıl ve ne zaman ortaya çıkabileceğidir. SARS-CoV, MERS-CoV ve SARS-CoV-2’nin tümü betakoronavirüslerdir ve ilk ikisi yarasalardan kaynaklanır. Genom replikasyon mekanizmaları CoV’ler arasında yüksek oranda korunduğundan, zoonotik yayılmaya karşı ana engellerin reseptör bağlanması ve henüz tanımlanmamış diğer temel konakçı faktörlerin mevcudiyeti gibi görünmektedir. Mutasyonlar, ara konakların içinde adaptasyon sırasında kademeli olarak birikebilir ve yakın zamanda bildirilen SARS-CoV-2’nin insanlardan minklere ve tekrar insanlara bulaşması, bu tür bariyerlerin kolayca aşılabileceğini düşündürmektedir.
COVID-19’lu insanlar arasındaki önemli bağışıklık tepkisi varyasyonlarının altında yatan mekanizmalar da büyük önem taşımaktadır. Son çalışmalar, IFN-I bağışıklığının doğuştan gelen hataları ve interferonlara karşı otoantikorlar gibi şiddetli COVID-19 ile ilişkili insan genetik varyasyonlarını tanımlamıştır. Yüksek derecede patojenik CoV’lerin patogenezi ile düşük patojenik muadillerinin patogenezi karşılaştırılarak yeni anlayışlar elde edilebilir. Patogenezin konakçı ve viral belirleyicilerinin tanımlanması da önemli klinik etkilere sahiptir ve terapötik müdahaleler için yeni hedeflere yol açabilir.
Küresel bilim camiasının ortak çabasıyla, SARS-CoV-2 ve COVID-19 ile ilgili araştırma keşifleri günlük olarak yapılmakta ve paylaşılmaktadır. Antiviraller ve aşı adaylarının klinik deneylerinden elde edilen umut verici sonuçlar, bize COVID-19 pandemisini sona erdirmenin sadece bir zaman meselesi olduğu konusunda umut veriyor. Bununla birlikte, SARS-CoV-2, zoonotik potansiyele sahip sayısız viral patojenden sadece biridir. Yalnızca CoV’lerin ve diğer (yeniden) ortaya çıkan virüslerin biyolojisi ve patogenezi üzerine sürekli araştırma, gelecekteki pandemilerde üstünlük kazanmamızı sağlayacaktır.
Kaynak (değiştirilerek): Similarities and Dissimilarities of COVID-19 and Other Coronavirus Diseases
