Moderna ve Pfizer’in COVID-19 aşılarından çok önce bilim insanları, bulaşıcı hastalıklar, kanser vb mücadelelerde genetik olarak kodlanmış aşıların kullanımını düşünüyorlardı.

mRNA aşıları, hücrelerimize viral proteinler üretmesi için genetik kod sağlayarak çalışır. Hastalığa neden olmayan proteinler üretildikten sonra vücut virüse karşı bir bağışıklık tepkisi başlatarak kişinin bağışıklık geliştirmesini sağlar. mRNA, teorik olarak herhangi bir proteini üretmek için kullanılabilir; bunun tersi, proteinlerin kendilerinden veya aşılarda tipik olarak kullanılan virüslerin inaktive ve zayıflatılmış versiyonlarıdır.
Hastalıklarla savaşmak için faydalı proteinler üretmek için mRNA kullanma fikri yıllardır bulunmaktadır. Ancak şimdiye kadar, bu teknolojiyi kullanan hiçbir aşı, klinik deneylerde bu kadar ileri gitmedi.
Bilim insanları, 1990 yılında hastalıklarla savaşta gerekli proteinleri üretmek için gen bazlı terapötiklerin kullanılması için hücrelere RNA veya DNA enjekte ederek ilgili proteinleri başarıyla ürettiğini bildirdi. Bu yöntem potansiyel olarak bir devrim niteliğindeydi: Teorik olarak, böyle bir yöntem vücudun patojenlere karşı bağışıklığını artırmak, kanser ve nadir görülen genetik hastalıklarla savaşmak için kullanılabilirdi.
Ancak, tüm bu yönlerine rağmen, mRNA ile çalışmanın getirdiği zorluklar vardı. Doğal bir mRNA, yalnızca düşük seviyelerde protein üretir ve vücut içinde çok hızlı bir şekilde parçalanır. Üstelik RNA, kodladığı proteine verilen tepkiden bağımsız kendisi de bir bağışıklık tepkisini tetikleyebilir. Çünkü, çalışmalar gösteriyordu ki, insanlara veya hayvanlara yabancı RNA enjekte ederseniz, çok ciddi bir enflamatuar tepkiye ortaya çıkabiliyordu.
Bu sorunlar nedeniyle bu mRNA teknolojisinin yerine daha kararlı ve çalışması daha kolay olan DNA ile aşılar geliştirmeye odaklanmanın daha uygun olacağı düşünüldü.
Ancak, daha sonra kaydedilen birkaç önemli teknolojik ilerleme, bugün Moderna ve Pfizer / BioNTech’in SARS-CoV-2 aşılarının başarısına katkıda bulundu. 2000’lerin başında, RNA’nın yapı taşlarını (nükleozitler) değiştirerek tekniğin bazı temel sınırlamalarının üstesinden gelinebileceği düşünüldü. Gerçekten de 2005 yılındaki bir mihenk taşı çalışmada, modifiye edilmiş, sentetik nükleozitlerin hem mRNA’dan protein üretimini artırabileceğini hem de bağışıklık sisteminin mRNA moleküllerine tepkisini büyük ölçüde bastırabileceğini bildirildi. Bu çalışmayı yapan bilim insanlarından biri olan Dr.Karikó şu anda BioNTech’te kıdemli başkan yardımcısıdır.
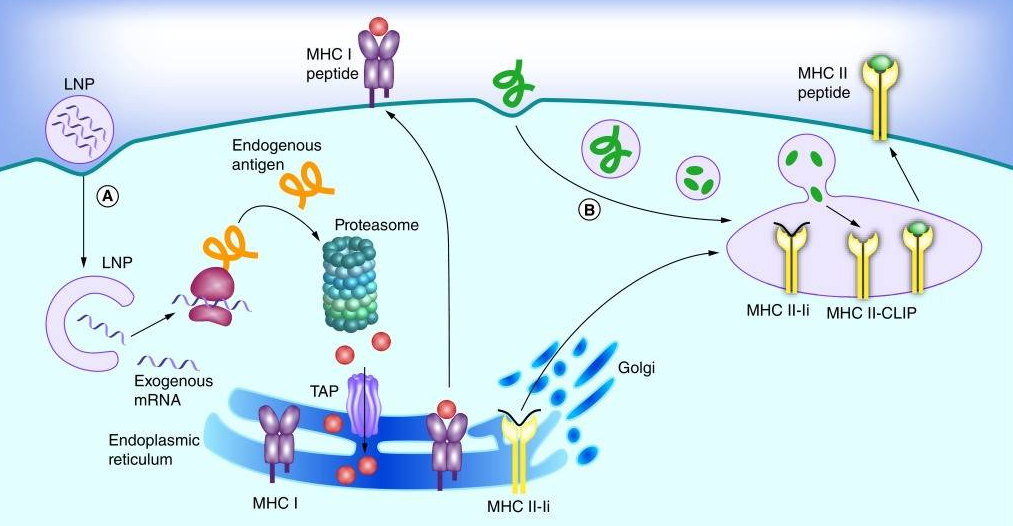
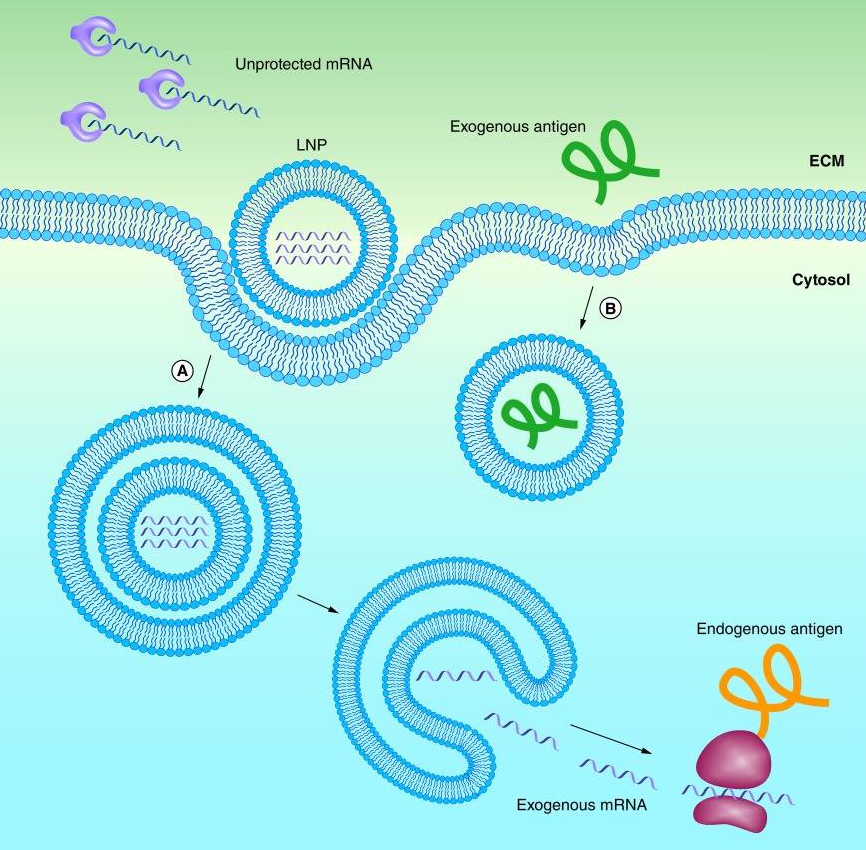
Bu gelişmelere rağmen, mRNA’yı enjeksiyondan sonra hızlı bozunmaya karşı koruyacak bir yönteme hala ihtiyaç duyuluyordu. Nered ise aynı bilim insanları insanları mRNA’yı lipid nanopartiküller (LNP’ler) olarak bilinen küçük yağ kabarcıkları ile kaplayarak mRNA molekülünü koruyabildiler ve hücrelere taşınmasını artırabildiler.
Daha sonra mRNA aşıları, kuduz, grip ve Zika gibi çok çeşitli bulaşıcı hastalıklar için klinik olarak test edildi. Ancak hiçbiri erken aşama klinik deneyleri geçemedi.
Aslında, Pfizer / BioNtech ve Moderna’nın SARS-COV-2 aşıları beklentileri fazlasıyla aştı. Her ikisi için de yüzde 90’ın üzerinde rapor edilen etkinlik, ABD Gıda ve İlaç İdaresi’nin acil kullanım yetkisi (EUA) beklediği %50 etkinlik sınırını aşmaktadır.
COVID-19 için mRNA aşılarının erken başarısı, bilim insanlarını bu teknolojinin geleceği konusunda iyimser kılıyor ve daha birçok aşı üreticisi muhtemelen tekniğe ilgi duyacak.

Özetle…
- DNA ve mRNA aşıları arasındaki farklar, DNA aşıları gibi mRNA aşıları, transfekte hücrelerde antijenlerin sentezini indükler ve bu nedenle, antikor, Th1 yardımcı CD4 T hücreleri ve sitotoksik CD8 T hücreleri dahil olmak üzere geniş bir bağışıklık tepkisini etkinleştirir.
- mRNA sitozole (hücrenin çekirdeği etrafındaki sıvı kısma) verildiğinden, işlem daha kolaydır ve DNA’dan çok daha güvenlidir, çünkü sitozoldeki mRNA çekirdekteki genom ile etkileşime girmez ve sadece geçici olarak ifade edilir.
- Lipid nanopartiküller (LNP’ler) mRNA’yı bozulmaya karşı korur ve endositoz ve endozomlardan salınmasına yardımcı olur.
- Adjuvanlar, LNP’lere dahil edilebilir ve immün aktivasyonuna ve potansiyel olarak immün tepkisinin uyarlanmasına yardımcı olabilirler.
- LNP’ler, yüzeylerini belirli ligandlarla süsleyerek belirli hücre tiplerine hedeflenebilir.
- Mikroakışkan cihazlar gibi yöntemler kullanan LNP sentezi ölçeklenebilir.
- Bazı katyonik lipidoidler toksisite sergiler ve tekrarlanan uygulamalar polietilen glikole karşı bir bağışıklık tepkisi oluşturabilir.
- mRNA aşıları şu anda kanser immünoterapisindeki uygulamalar için değerlendirilmekte ve profilaktik aşı uygulamaları olarak ilk defa denenmektedir.

Hiç yorum yok:
Yorum Gönder