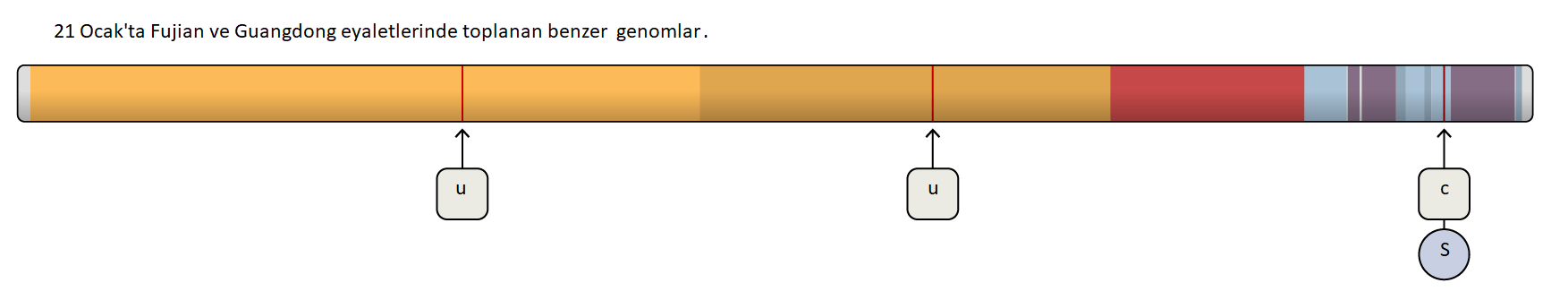
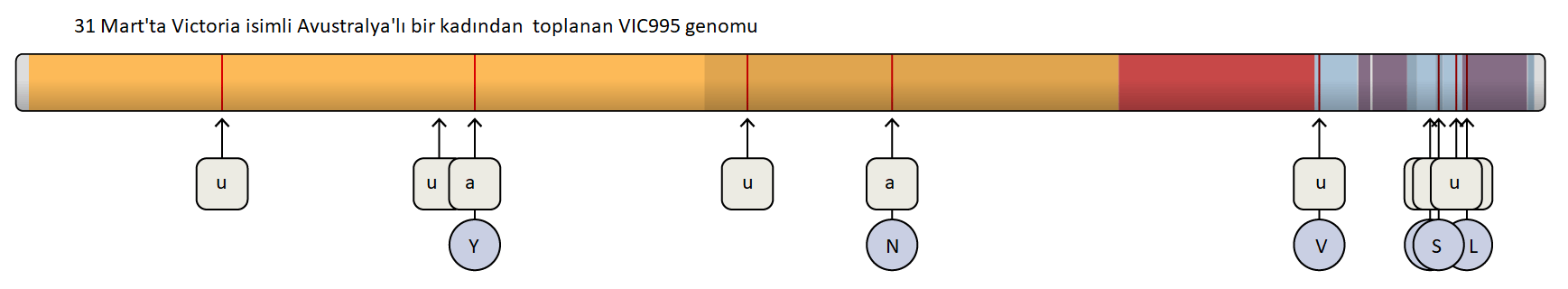
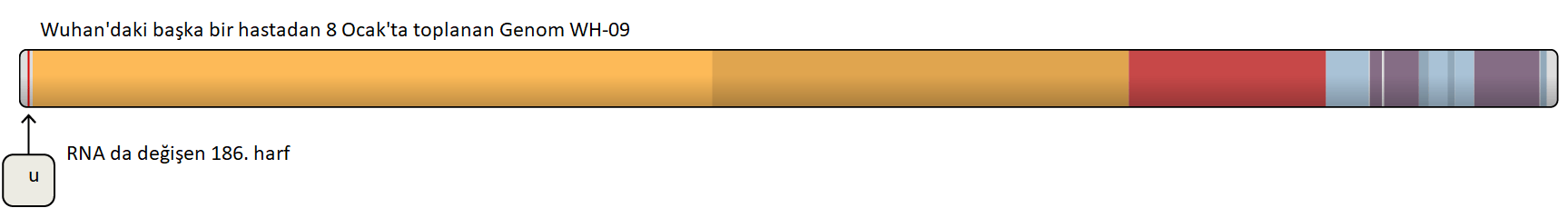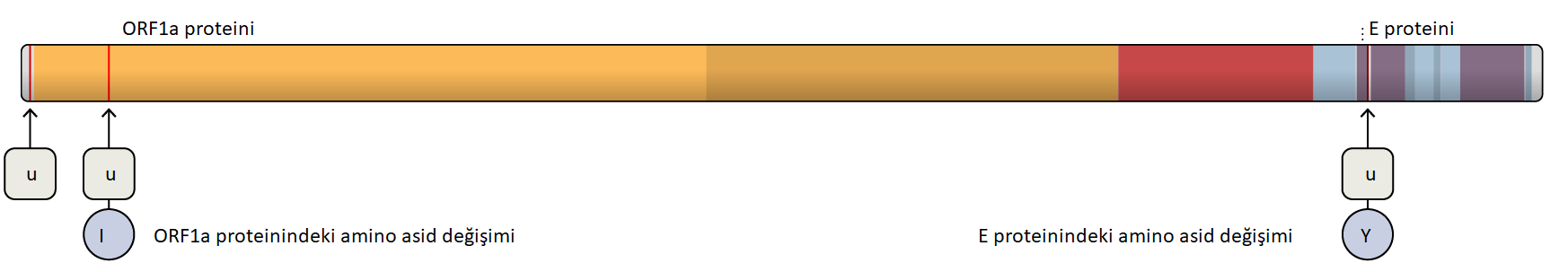Hücrelerin dışında “tüylü” elbiseleri vardır. Bu size şaka gibi gelebilir, çünkü bilim kitaplarında hücreler genellikle içi su dolu balonlar gibi pürüzsüz bir şekilde resmedilirler. Fakat bu kesinlikle doğru değildir.Atife Nida Karakaya, (İnönü Üniversitesi, Moleküler Biyoloji ve Genetik Bölümü, Yüksek Lisans Öğrencisi), Düzeltme: Hikmet Geçkil (İnönü Üniversitesi, Moleküler Biyoloji ve Genetik Bölümü)
Gerçekte, bir hücrenin yüzeyi, ağacın gövdelerindeki dallar ve yapraklar gibi uzanan karmaşık ve çeşitli karbonhidrat (şeker) kümeleri ile süslenmiştir. Bu kısım, bir hücrenin dünyaya gösterdiği yüzüdür. Bu karmaşık karbonhidrat veya glikanlar, diğer hücreler veya moleküller ile karşılaşmalarında ve etkileşimlerinde kritik rol oynarlar.
Biyomedikal araştırmalarda glikanların önemi gittikçe artmaktadır. Çünkü araştırmacılar, bu şekerlerin bağışıklık aktivasyonu, düzenlenmesi ve yönlendirilmesinde yardımcı olduklarını kanıtlamıştır.
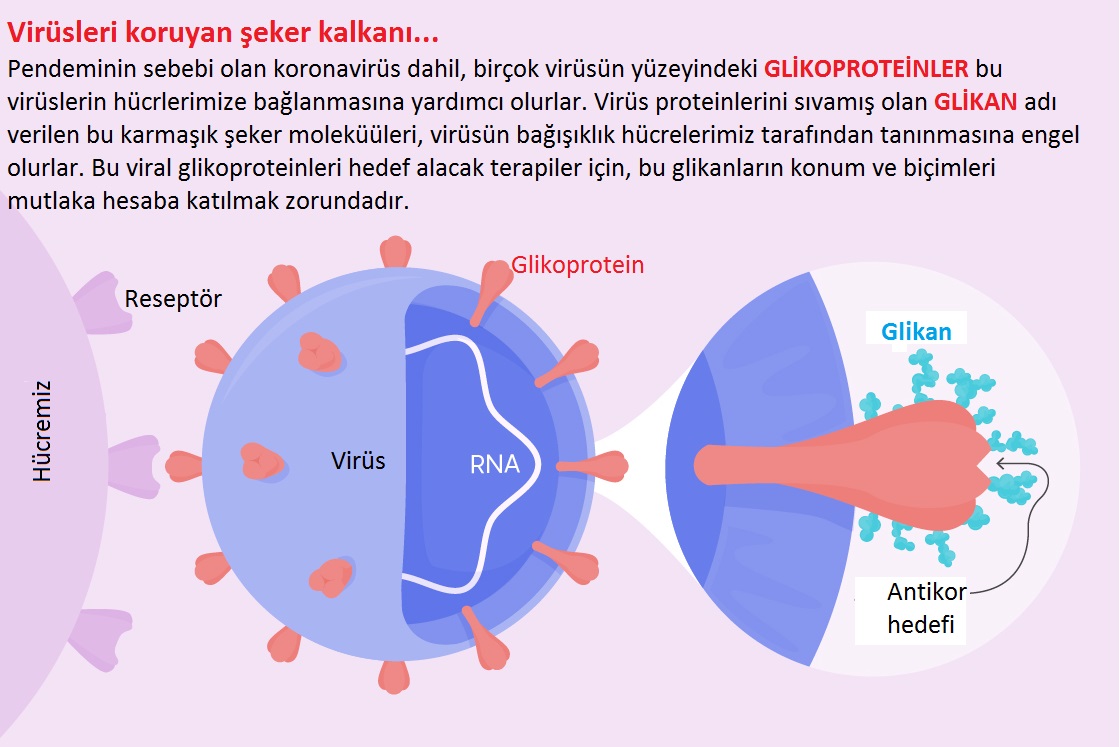
“Glikanlar”ın insan sağlığı ve hastalıklarındaki yapı ve işlevlerinin incelenmesi ile çeşitli patojenler daha iyi anlaşılmış ve yeni terapilerin bulunması sağlanmıştır. Ancak COVID-19 salgını bu konuya daha fazla aciliyet getirdi. Birçok bilim insanı glikan konusundaki bilgisinin SARS-CoV-2 virüsü ile mücadele için temel olabileceğine inanıyor. Bu nedenle, birkaç araştırma ekibi, bu virüsün potansiyel güvenlik açıklarına işaret eden glikanlarının ilk ayrıntılı modellerini yayınladı.
Şekerlerin Hayati Kullanımları
Genomik ve proteomik çalışmalrı hep glikomiklerin önüne gemiştir. Bunun nedeni şekerlerin karmaşıklığı onları incelemeyi zorlaştırmaktadır. DNA, RNA ve proteinler, tanımlanmış kurallara göre inşa edilen doğrusal moleküllerdir. Bilim insanları bunları sıralamak, analiz etmek ve manipüle etmek için araçlara da sahiptir. Fakat glikanlar bilinen bir kalıbı olmayan dallanmış bir yapı gösterirler. Örneğin, iki aynı protein üzerindeki aynı bölge, çok farklı dallanma motifleri olan glikanlara sahip olabilir.Glikanlar ayrıca DNA veya proteinlerden daha fazla potansiyel konfigürasyona sahiptir: örneğin, üç farklı nükletid altı farklı DNA sekansı ve üç farklı amino asit altı farklı peptit oluşturabilirken, üç glikan yapı taşı, binlerce yapı oluşturabilir. Glikanlar esnek, titrek ve değişkendir. Girift, dinamik ve tahmin edilemeleri zordur. Analizleri daha sofistike ekipman ve daha fazla teknik uzmanlık gerektirir.
Sonuç olarak, “glikobiyoloji alanı daha uzman bir alt disiplini oluşturur. Bununla birlikte, 2010'larda, bu karbonhidratların biyolojide daha geniş bir şekilde dikkate alınması gerektiği anlaşıldı. Şekerler, sadece mutlu etmek için Noel hediyeleri değildir. Bunlar evin (hücrenin) yapısının kritik unsurlarıdır.
Glikanlar proteinlerin kararlı hale gelmesine yardımcı olur ve onların doğru katlanmasına da katkıda bulunurlar. Hücrelerin yüzeyindeki bir protein reseptörün hareket ve fonksiyonunu düzenlerler. Büyüme faktörü sinyali yolağından tutun sperm ve yumurtanın bağlanmasına kadar birçok süreçte rol alırlar. İnsanların kan grubunu belirlerler.
Kardiyovasküler (kalp-damar) hastalık, diyabet (şeker hastalığı) ve diğer birçok tıbbi durumlarda rol oynarlar. Yani, bu şekerler vücutta muazzam çeşitlilikte rollere sahiptir. Glikanların bileşimlerini, nerede bulunduklarını ve fonksiyonlarını henüz yeni anlamaya başlıyoruz.
Bu nedenlerden dolayı, şekerleri hesaba katmadan, proteinlerin ve hücrelerin nasıl etkileşime girip işlev gördüklerini tam olarak anlayamayız.
HIV Bize Bu Konuda Yol Gösteriyor
Glikobiyolojinin yükselişi özellikle immünoloji (bağışıklık bilimini) dönüştürücü olmuştur. Glikanlar bağışıklık hücrelerinin aktivasyonu, düzenlenmesi ve akışına yardımcı olurlar.Bazı bağışıklık hücrelerimiz, diğer insanların, hayvanların veya patojenlerin hücrelerinin yüzey şekerlerini yabancı olarak algılar ve onlara karşı bir cevap verebilir.
Bakteriler ve virüsler bu olgudan faydalanmak için evrimleşti. Patojenler, konakçı hücrelere erişme, farklı hedef dokulara gitmek, bağışıklık sisteminden kaçınmak ve belirli hastalıklara yol açabilecek iltihaplanmayı başlatmada bu glikanları yolun her adımında kullanırlar.
Ancak bilim insanları, insanlarda bağışıklık yetmezliğine sebep olan HIV’nin biyolojisini detaylıca araştırmaya başlayana kadar bu bağlantıları henüz tam olarak bilmiyordu. Yani diğer deyişle, glikanlarla ilgili pek çok şeyi HIV yüzünden öğrendik.
|
 Araştırmalar, HIV'inin yüzeyinin nerede ise tamamının glikanla kaplandığını gösteriyordu. Öylesine yüksek bir şeker yoğunluğu vardır ki, bu şekerlere insan glikanları için mümkün olan kimyasal değişiklikler yapmak nerede ise imkansızdı ve bağışıklık sisteminden saklanabiliyorlardı.
Araştırmalar, HIV'inin yüzeyinin nerede ise tamamının glikanla kaplandığını gösteriyordu. Öylesine yüksek bir şeker yoğunluğu vardır ki, bu şekerlere insan glikanları için mümkün olan kimyasal değişiklikler yapmak nerede ise imkansızdı ve bağışıklık sisteminden saklanabiliyorlardı.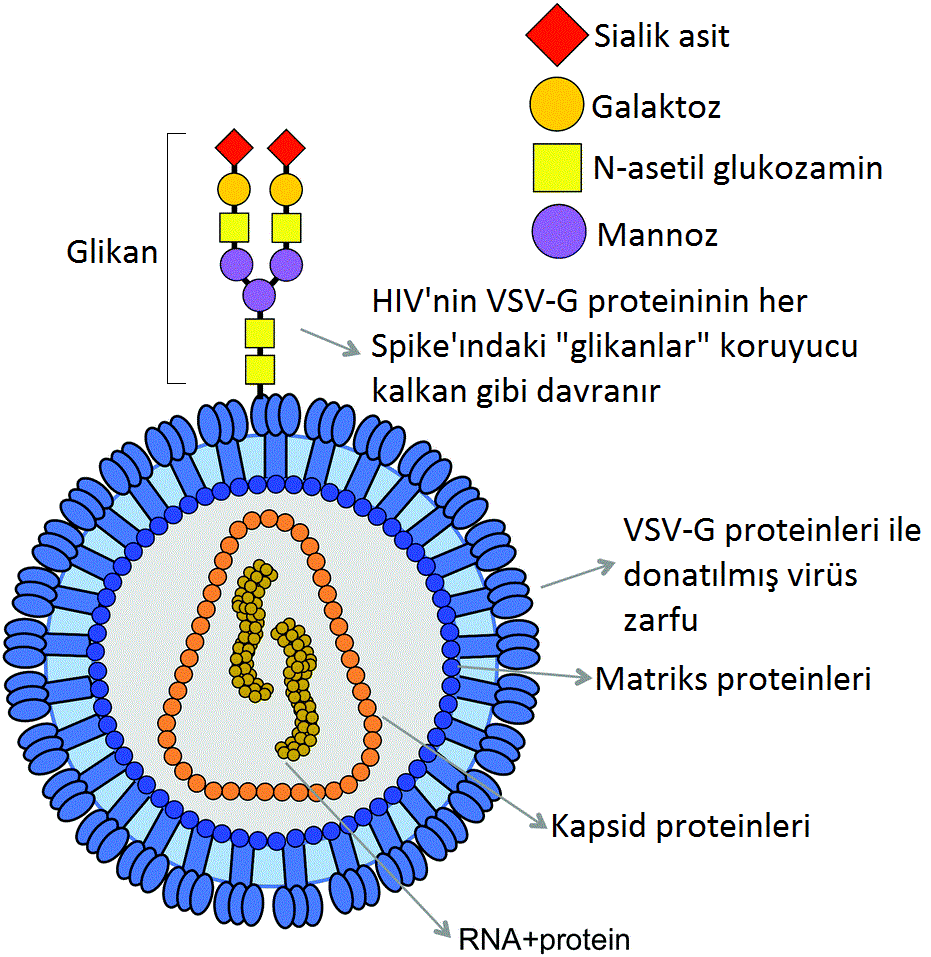
Virüs üzerindeki bazı glikan yamaları daha az olgun, daha ilkel bir kimyasal formda idi. Bu primitif glikan yamaları HIV’in hem başarısı hem de zayıf noktaları idi. Yamalarını dolaşımdaki bağışıklık hücrelerine sunarak, virüs lenf düğümlerine kadar gelebiliyor ve orada T hücrelerini enfekte edebiliyordu.
Fakat birkaç yıl sonra, kronik olarak enfekte olmuş hastaların üçte birinde, bağışıklık hücreleri glikanları yabancı olarak tanımaya başlar ve patojenle savaşmak için antikorlar üretirler. Keşfedilen bu antikorlardan ilki, HIV üzerinde belirli bir glikan kümesini tanıyordu. Ve bu büyük bir sürpriz oldu. Çünkü bilgilerimize göre, antikoarlar genellikle şekerleri değil proteinleri hedeflerdi. Fakat bu şekerler virüsler için insan hücreleri tarafından üretildiklerinden bunları hedef almak o zamana kadar mantıklı gelmiyordu. Çünkü onları hedef almak “otoimmün” bir yanıta yol açabilirdi.
Dolayısı ile, o zamana kadar şekerlere karşı bir antikor oluşturulamayacağı köklü bir dogma idi.
Ancak daha sonra bu glikanlara karşı birçok antikor tanımlandı ve protein/glikanın kombinasyonunu tanıyacak birçok antikor geliştirildi. Ayrıca, bu glikanlar virüsün proteinlerine erişimi engellediklerinden, bu zorluğu aşmak için de yöntemler geliştirildi. Yani, bu şekerler nötralize edici antikor çalışmalarını tamamen şekillendirmeye başladı.
Araştırmacılar, HIV ile savaşırken bağışıklık sistemini uygun şekilde uyarmak için, aşının glikan içermesi gerektirdiğini fark ettiler. Çıplak viral proteinlere karşı iyi çalışan bir aşı, glikan kalkanlarına sahip bu proteinlerin arkasına saklanan virüse karşı etkili olmayabilirler.
Dolayısı ile, virüsün glikanlarını tanıyan yeni HIV inhibitörleri geliştirmeye yönelik çabalar devam etmektedir. Bu antiviral tedavilerin bazıları klinik çalışmalara bile geçmiştir.
Önemli ama Korunmasız Bir Kalkan
Yoğun bir glikan kalkanı, grip virüslerini sadece bağışıklık sisteminden maskeleyerek değil, aynı zamanda gribin hareketli bir immünolojik hedef haline gelmesini de engeller.Virüsler, şekersiz bölgelere yeni şekerler ekleyerek, daha önce etkili olan antikorları etkisiz hale getirebilir.
Ancak virüsler glikanlara başka şekillerde de güvenirler. İnfluenza (grip) kendisini konakçı hücre içine sokarken konakçı üzerinde yaygın olan bir glikana bağlar. Aslında şekerler, virüsün hangi dokulara ve hangi canlı türlere bulaşabileceğini belirlerler.
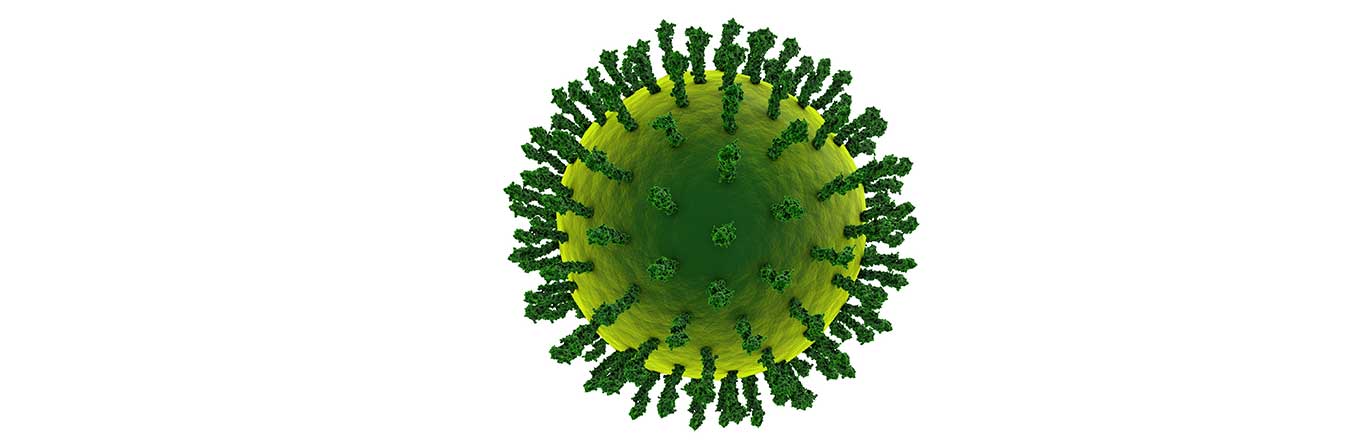
Örneğin, kuş gribi mutant suşları insan konakçılarına atladığında, bunun nedeni genellikle virüsün belirli glikanlarla etkileşimlerinin değişmiş olmasıdır. Bu virüsün glikanı, insanları kuş gribinden koruyan glikanlara göre sadece küçük bir farka sahiptir.
İnfluenza virüsü ayrıca konakçı hücrelerden kaçmak ve vücuda yayılmak için glikanları kesen bir enzim de kullanır. Tamiflu dahil olmak üzere çeşitli etkili grip antiviralleri, bu enzimleri inhibe eder.
Bakteriler de vücutta maskelenmek için benzer şekilde glikanlarını kullanır. Bazı bakteriler kendilerini insan glikanlarını taklit eden şeker kapsülleri ile kaplar; glikan bazlı aşıların bunlara karşı etkili olduğu kanıtlanmıştır. Bazı patojenler, bağışıklık sisteminin kendilerine karşı esen fırtınasından kaçmak için glikanları tuzak olarak bırakırlar.
Birkaç otoimmün bozukluk (örn., Guillain-Barré sendromu gibi), istilacıların glikanlarından kaynaklanan ve daha sonra sağlıklı insan dokularıyla çapraz reaksiyona giren antikorları tetikler.
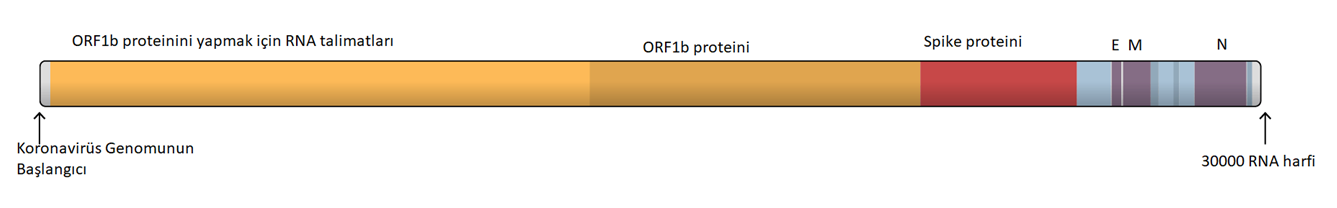
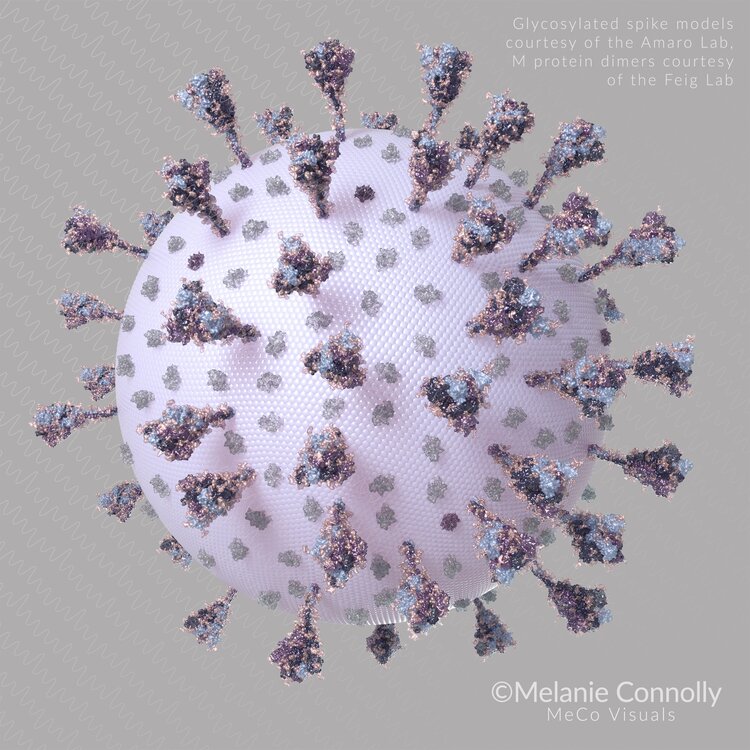
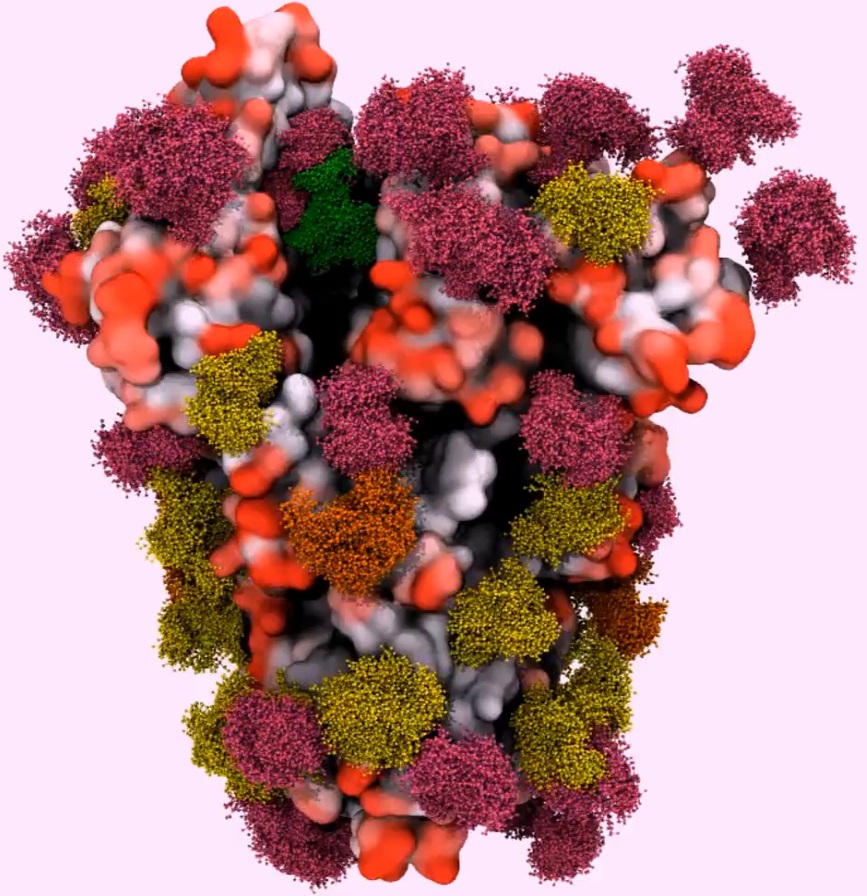
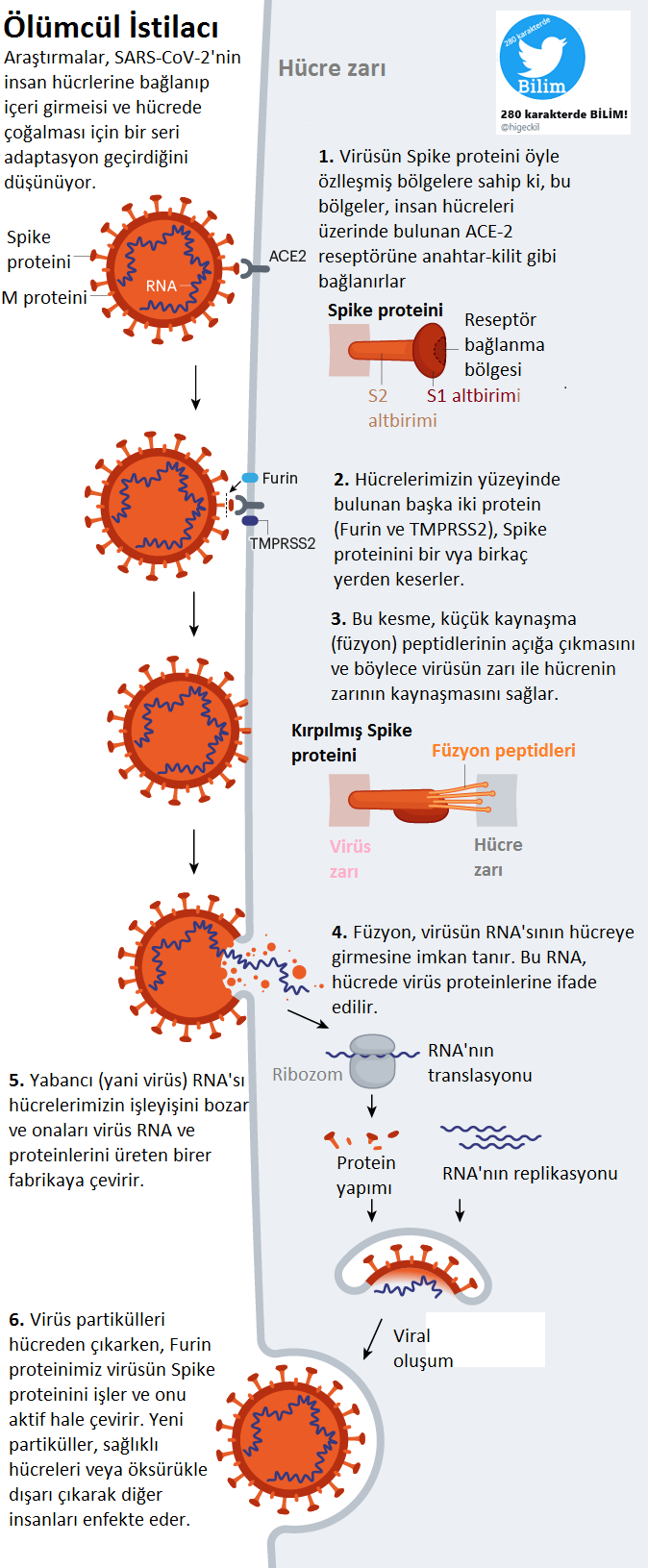
Şimdilerde, bilim insanları COVID-19'un nasıl çalıştığını daha iyi anlamak için dikkatlerini SARS-CoV-2 virüsünü kaplayan glikanlara yönlendiriyorlar. Koronavirüs tarafından insan hücrelerine bağlanmak için kullanılan Spike (başak) proteininin bir glikan kalkanıyla kaplandığını, ancak HIV ve diğer birçok virüsten daha az yoğun olduğunu buldular.

Dahası, bu glikan bölgeleri gripte ölçüde mutasyona uğramış gibi görünmemektedir. Bu da antikorların SARS-CoV-2'ye karşı başarılı bir araç olabileceğini düşündürmektedir. Glikanlar, başak proteininin belirli bölgelerini korur. Bu korumada, glikanların başka bir rolünün olduğunu şüphelendirecek boşluklar bulunmaktadır.
Viral proteinlerin kararlılığına katkı sunmaktan, enfekte ettiği hücrelere bağlanmasına yardımcı olmasına kadar, bu olası farklı işlevleri birbirinden ayırmak için modeller geliştiriliyor.
Bir grup bilim insanı, glikan içeren potansiyel bir antikor tedavisinin mümkün olabileceğini ileri sürmektedir. Devam etmekte olan diğer araştırmalar, korunmasız protein veya glikan-protein kombinasyonlarının hedeflenecek potansiyel güvenlik açıkları olabileceğini göstermektedir.
Ancak şimdilik, klinik çalışmalarda denenen COVID-19 aşılarının genellikle DNA veya RNA bazlı olduğu görülmektedir.
[caption id="attachment_5925" align="alignnone" width="900"]
 Grafik resim. Dr. Özdoğan'ın izniyle[/caption]
Grafik resim. Dr. Özdoğan'ın izniyle[/caption]Böyle çok yönlü yeni bir virüs, gözlerimizi neredeyse her şeye açmamızı gerektirir.
Daha önceki binlerce glikan analiz verisi, COVID-19 verileri ile birlikte değerlendirilerek, bu şekerlerin enfeksiyon riski ve şiddetli semptomlara yatkınlıktaki rolleri tahmin edilmeye çalışılıyor.
Bazı araştırmalar ise kanser dahil birçok hastalıkta bu glikanların rollerine odaklı. Yani “glikomik” üstesinden gelmemiz gereken bir sonraki engel gibi görünüyor. Genomik ve proteomikten sonra bu konulardaki yeni cephe glikomiktir.
Kaynak: Quanta Magazine











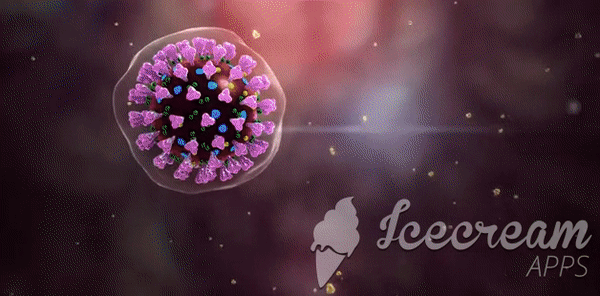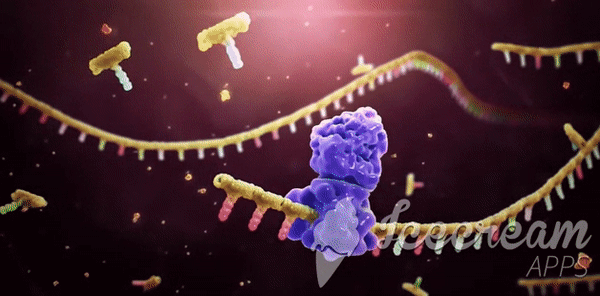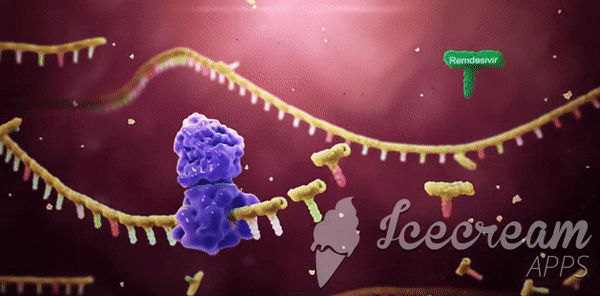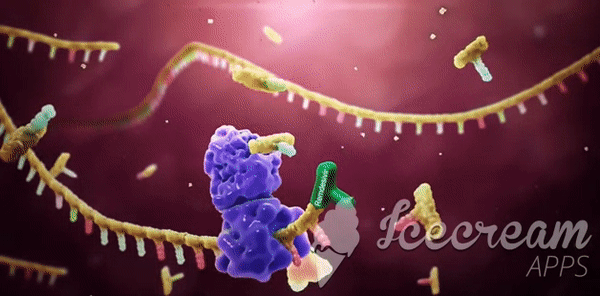

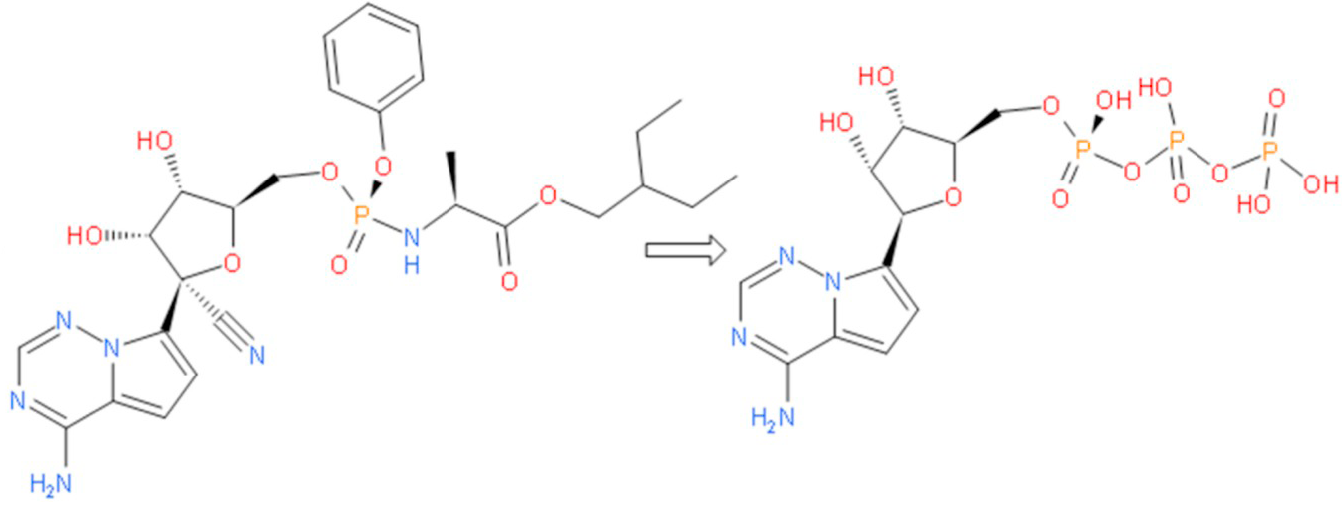
 Remdesivir'in çalışma mekanizması: Yapısal olmayan bir protein olan NSP12'nin diğer adı RdRp'dır. Başka bir protein olan Bu iki protein olan NSP8, NSP12’ye yardımcı olur ve beraber yeni RNA genomunun yapılıp bir virüsün içine girmesine ve böylece yeni virüs kopyalarının yapılmasına yardımcı olur.[/caption]
Remdesivir'in çalışma mekanizması: Yapısal olmayan bir protein olan NSP12'nin diğer adı RdRp'dır. Başka bir protein olan Bu iki protein olan NSP8, NSP12’ye yardımcı olur ve beraber yeni RNA genomunun yapılıp bir virüsün içine girmesine ve böylece yeni virüs kopyalarının yapılmasına yardımcı olur.[/caption]