Scientia, Fortitudo et Virtus (Bilgi, Cesaret ve Fazilet)
26 Aralık 2017
Mutlu Yıllar (Happy New Year)!
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Yılın bilim görseli: Bir Örümceğin Karın Deseni!
İnanılmaz! Bir ipek böceğinin karın deseni.
Bilim dünyası biyolojik karmaşıklığı daha iyi anlamak için doğal dünyayı her zaman araştırmıştır. Modern toplum, doğayı her zaman referans alarak insan yapımı araçlar geliştirmiştir. Bilim ve mühendislik alanındaki araştırmacılar farklı organizmaların nasıl hareket ettiğini, işbirliği yaptığını, savaştığını, enerji tükettiğini ve depoladığını, nasıl hayatta kaldıklarını ve çoğaldıklarını hep araştırmışlardır.
Kaynak: Science 360 News, Discover Magazine
 |
| Avustralya Maratus "tavuskuşu" örümceğinin kur yapmak için dans ettiğinde açığa çıkardığı karın bölgesindeki desenin yakın çekimi. Resim: Jurgen Otto |
Bilim dünyası biyolojik karmaşıklığı daha iyi anlamak için doğal dünyayı her zaman araştırmıştır. Modern toplum, doğayı her zaman referans alarak insan yapımı araçlar geliştirmiştir. Bilim ve mühendislik alanındaki araştırmacılar farklı organizmaların nasıl hareket ettiğini, işbirliği yaptığını, savaştığını, enerji tükettiğini ve depoladığını, nasıl hayatta kaldıklarını ve çoğaldıklarını hep araştırmışlardır.
 |
| Habronattus: Sıçrayan örümcek |
 | |
|
 |
| Avustralya Maratus’u gibi sıçrayan örümcekler avlarını yakalamaktan ziyade, onları takip edip aniden üzerlerine atlarlar. Örümceğin ipeği avlanmada önemli bir rol oynamaktadır. Çoğu zaman, avın üstüne atlanırken kendilerini demirlemek için ipek ipliklerinden yararlanırlar. |
 |
| Örümcekler insanlar tarafından onlara karşı yapılan mücadelelere karşı yeni yollar keşfederler. Böcekler ABD tarımının her yıl yüzde 25'ini yok ediyor ve ülkede her yıl püskürtülen 1 milyar pound'dan fazla kimyasal zararlı böcek ilacı için giderek daha fazla direnç kazanmış durumda. Bazı örümceklerin zehiri, insanlar için güvenli ve çevre dostu bir çözüm sunabilir. |
 |
| Sıçrayan örümceklerin 8 gözü vardır. İkisi öndeki esas gözler iken, altısı yüzlerinin yan tarafında bulunur. Bilim adamları bu örümceklerin beyinlerinin sekiz gözden gelen bilgiyi nasıl işlediklerini anlamak için onların sinir devrelerini inceliyorlar. Bulguların bir gün insan uygulamaları olabilir. Örneğin, bir nöronun (sinir hücresi) diğer nöronlarla nasıl birlikte ve eşzamanlı çalıştıklarını anlayabiliriz. |
Kaynak: Science 360 News, Discover Magazine
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
2017’de Bilim Dünyası ve Buluşları
Aşağıda bilim dünyasının iki “Top” dergisine göre bu yılın “Breakthroughs” yani “Çığır Açıcı Buluşlar”ı var. Bir fikir vermesi için bu iki derginin neden “Top” olarak kabul edildiğine bir bakalım: Nature ve Science. Dilimize çevirirsek bu bu iki derginin adı “Doğa” ve “Bilim“
Bilim camiasının araştırma sonuçlarını yayımladıkları yaklaşık 15,000 dergi var. Bunların % nerede ise 99’unun Etki Değeri (Impact Factor) 0 ila 10 arasında. Ancak, bu iki derginin Etki değerleri 30 ila 40 arasında.
Science daha çok Fizik ağırlıklı, Nature ise daha çok Biyoloji ağırlıklı makaleler yayınlıyor. Ancak, bu iki dergide birçok farklı konuda da (sosyal bilimler, arkeoloji, linguistik ve daha birçok alan) yayınlar yapılıyor.
Bu iki dergi hakkında diğer ilginç bir şey Noel hariç her hafta çıkıyor olmaları. Yani yılda 55 sayı! Halbuki diğer dergiler genel olarak aylık veya 2, 3 veya 4 ayda bir yayımlanıyorlar.
Bilimdeki büyük buluşlar ve diğer dergilerin cesaret edemediği radikal bilimsel hipotezler de bu dergilerde yayımlanabiliyor.
Bu ünlü dergilerde yayın yapmanın dayanılmaz cazibesi, bazı bilim insanlarının olamayan şeyleri varmış gibi gösteren bilimsel çarpıtmalara dayalı yayınlara da zorlamıyor değil. Dolayısı ile, bilim dünyasının “kıblesi” gibi görülen bu iki dergi, aynı zaman bazı makalelerin bilimsel sahtekarlıktan geri çekildiği (retraction) kötü üne de sahipler…
her ne ise …
Bu dergiler tarafından seçilen “Yılın Buluşların”a geçelim (Yorumlar bana aittir!).
Önce Science‘in “Breakthroughs”ları …
1. Kozmik Birleşme

İki nötron yıldızının birleşmesi 17 Ağustos’ta binlerce gözlemciyi ve dünyanın dört bir yanındaki bilim insanlarını büyüledi: Yaklaşık yüz otuz milyon ışık yılı uzaklıktaki iki nötron yıldızının muazzam bir patlama ile birbirlerine sarmalanması, gama ışını dedektörlerinden telsiz teleskoplarına kadar bir seri araçla belirlendi. Patlama, birkaç kilit astrofizik teoriyi doğruladı. Birçok ağır elementin bir doğum yerinin olduğunu ortaya koydu. Ve genel görelilik teorisini daha önce hiç olmadığı gibi test etti.
Yorum: Dediğim gibi. Science fizik alanını çok seven bir dergi. Dolayısı ile yılın buluşunu bu alandan seçmesi sürpriz değil! Elde edilen veriler ve insan hayal gücü ile oluşturulmuş henüz çok spekülatif bir şey! Bir süre sonra yanlışlanırsa şaşırmayacağım… Ancak Nobel Ödülleri verildi bile!
2. Atomik seviyede hayat

Dondurmaya dayalı elektron mikroskopu (bu yılın Nobel Kimya Ödülünü aldı), yani cryo-EM molekülleri suda hareketsiz halde tutmak için sıvı etan kullanır. Araştırmacılar daha sonra onları bir elektron mikroskopu altında görüntüler ve görüntüleri sıralamak ve verileri tutarlı bir yapıya toplayabilmek için bilgisayar programları kullanırlar. Yapısal biyolojinin altın standardı olan x-ışını kristalografisinin aksine, cryo-EM hedef moleküllerin kristalleştirilmesini gerektirmez. Tekniğin kökleri yıllar öncesine dayanıyor.
Yorum: Morfoloji yani yapı her zaman işlevi tam açıklamaz. Ancak, kristalografi gibi zor ve zahmetli bir işi daha pratik hale getiren bir teknoloji…
3. Homo sapiens ‘in daha derine uzanan kökleri

Fas’ta bir mağaradan bulunan insan kafatası, türümüz Homo sapiens‘in fosil kayıtlarını geriye itti ve bu yıl modern insanın kökeni çalışmalarına enerji verdi. Kafatası Etiyopya’daki fosillerden yaklaşık 100.000 yıl daha yaşlı.
Yorum: Şayet böyle ise, bizim gibi olan ilk insan Doğu Afrika’da değil, Kuzey Afrika’da yaşadı.
4. Nokta atışı hassasiyete sahip gen düzeltme

60.000’den fazla genetik yanlışlık insan hastalıklarıyla bağlantılı. Bunların yaklaşık 35.000’ine küçük hatalar sebep oluyor: genomda belirli bir noktada sadece bir DNA mektubunda bir değişiklik. Bu yıl, araştırmacılar böyle nokta mutasyonlarını düzeltmek için baz bir metot geliştirdi. Bu baz (DNA ve RNA’nın harfleri) düzenleme 2012’de güçlü bir laboratuar aracı olarak keşfedilen “moleküler makaslar” olan CRISPR-Cas sistemini kullanmakta.
Yorum: gerçekten de “nokta atışı veya vuruşu hassasiyette” mümkün olursa, birçok hastalığı embriyonik hücrelerden dolayısı ile doğacak bireyden silebiliriz… Bu çalışma ile, Aziz Sancar’ın yıllar önce keşfettiği ve bunun için Nobel Ödülü aldığı DNA tamir mekanizmasını kendimiz tüpte hücrelerimize uygulayabiliriz. Ancak, bunu sadece erken embriyonik safhada (yani hücreler heniz farklılaşmadan) yaparsak bir değeri olur. bebek oluşmaya bir başlayınca, bunun hiç bir uygulaması kalmaz…
5. Geniş yelpazeli bir kanser ilacı: Pembrolizumab (veya diğer ismi ile Keytruda)

İlaç melanoma ve bir seri tümör tipinin tedavisi için zaten onaylanmıştı. Gelişmiş tüm solid tümörler için reçetelendirilebiliyor. Ancak bir şartla: Kanser hücreleri “uyuşmazlık tamir eksikliği” yada İngilizce adı ile “mismatch repair deficiency” taşımalıdır. Bir “bağışıklık kontrol noktası inhibitörü” olan bu ilaç bu tür tamir eksikliği olan tümörleri eritiyor ya da en kötü ihtimalle onların ilerlemesini durduruyor.
Yorum: “Bin bir yüzlü” kanser yine bir yolunu bulur.
6. 2.7 milyon yıl önce dünyamızın atmosferi

Araştırmacılar 2.7 milyon yıl önce donan Antarktika bir buzulu keşfettiler. Bu, önceki herhangi bir buz örneğinden 1.7 milyon yıl daha eski. Dolayısı ile gezegenmiz iklim tarihi 1 milyon yıl daha geriye giderek anlayabileceğiz.
Yorum: son 100 yılda 1 milyon yıla eşdeğer bir atmosferik bozulmayı nasıl sağlamışız belki daha iyi anlarız…
7. Gen tedavisi zaferi
Araştırmacılar ölümcül kalıtsal bir kas-sinir hastalıkla doğan bebeklerin hayatlarını kurtardıklarını bildirdiler. Burada ana araç, gen terapisinde hedef hücrelere genlerin aktarılması için yaygın olarak kullanılan adeno-ilişkili virüs (AAV) adı verilen zararsız bir virüstür. Omur nöronlarına eksik bir gen bu yöntemle eklenmiştir. By yapılmasaydı bebekler 2 yaşından önce öleceklerdi. Araştırma, aynı zamanda daha kapsamlı bir kilometre taşına da işaret ediyor: beyne ve omuriliğe kan yoluyla taşınan patojenlerden ve toksinlerden koruyan zarın bir ötesine bu yeni geni aktarmış oldu. Bu özellik, diğer sinir hasarı hastalıklarında tedavi için gen terapisini kullanma kapısını açabilir.
Yorum: Gen tedavileri henüz emekleme aşamasında ve bir ton bilinmeyen var. Hem hastalıklar hem de kişiye özgü yönler. Kliniğe gelmesi ve yaygın kullanımı zaman alacaktır.
Kaynak: Science
Şimdi de Nature dergisinin 2017 “Breakthroughs”ları…
Henüz yayımlanmadı! Yayımlanınca burada olacaklar…
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
16 Aralık 2017
2017 Nobel Fizyoloji veya Tıp Ödülü: Günlük biyolojik saatimizin zemberekleri
Sirkadiyen ritimler fiziksel ve zihinsel performansımızı gece / gündüz döngüsüne göre kontrol ederler. Bu nedenledir ki güneş batımında uykumuz gelir, güneş doğunca uyanırız. Tabi bu sadece basit bir örnek. Bu ritimleri kontrol eden biyolojik saatler tüm canlılarda ve hücrelerde yerleşiktir ve her türlü hareketimizi kontrol ederler.
Bu yılki Nobel Fizyoloji veya Tıp Ödülü bu konudaki öncü çalışmalarından dolayı üç Amerikalı bilim adamına verildi: Brandeis Üniversitesinden Jeffrey Hall ve Michael Rosbash ve Rockefeller Üniversitesinden Michael Young.
 |
| Michael W. Young |
Galapagos Adalarındaki Darwin ispinozlarından modern şehir sakinlerine, organizmalar kendi çevrelerine adapte olurlar. Yeryüzünde gündüz ve gece döngüsü, hücrelerimizde bulunan biyolojik saatlerin evrimine yol açtı. Bu saatler farkında olmadan dinlenmemize, yiyecek aramamıza, tehlike veya yırtıcıları öngörmemize yardımcı olur.
Modern sirkadiyen biyoloji alanı, genetikçi Seymour Benzer ve öğrencisi Ron Konopka’nı meyve sineklerinde biyolojik zamanlamayı kodlayan genlerin izini sürdükleri 1970’lerdeki çığır açıcı çalışmalarına dayanmaktadır.
Neden sinekler?

Benzer ve Konopka basit bir deney yaptılar: meyve sineği Drosophila melanogaster‘in pupal (koza hali) durumundan ne zaman çıkacağını izlediler. Bu gelişim sürecine “eklosion” denir ve sirkadiyen ritimlerin karmaşık biyolojik sürecini incelemek için güçlü bir araç olarak kullanılmıştır. Drosophila pupaları yalnızca belirli bir saatte ortaya çıkar. Konopka, farklı sinek türleri için eklosion zamanlamalarını ölçüp, kötü zamanlamaya sahip olanları belirledi. Daha sonra bu kötü ritimleri olan sineklerde hangi genlerin yanlış çalıştığını araştırdılar. Bu sineklerden 3 mutantı izole ettiler. Mutant sineklerden biri günü 19 saat olarak, diğeri 28 saat olarak, üçüncüsü ise günü hiç algılamayan biyolojik saatlere sahipti. Her üçünde de DNA’daki değişiklik (mutasyon) ve X kromozomu üzerinde aynı gende idi.
Sonra yarış başladı ve 1984’te Jeffrey Hall, Michael Rosbash ve Michael Young’un ekipleri “peryot” adı verilen sineklerdeki saat genini nihayet tespit etti. Jeffrey Hall ve Michael Rosbash bu genin kodladığı PER adlı proteinin gece boyunca arttığını ve gün boyunca azaldığını keşfettiler. Böylece, bu protein seviyesinin bir şekilde hücrenin geri kalan kısmına zaman bilgisini iletebileceğini düşündüler.

Şekil. PER geninin geri bildirim düzenlemesini gösteren basit bir diyagram.
A) Hem PER mRNA’sı ve hem de PER proteini miktarında bir dalgalanma görülür. PER mRNA’sının en yükseğe çıkmasından birkaç saat sonra PER proteini birikmeye başlar. PER proteini, çekirdekte lokalize olur ve kendi geninin aktivitesini inhibe eder. B) PER genindeki ifadenin yani mRNA yapımındaki dalgalanmalar için ek proteinler gereklidir. Zaman sınırı olmayan (Timeless) gen tarafından kodlanan TIM proteini de dalgalanma gösterir ve PER proteini ile etkileşime girer. Bu etkileşim, PER proteinin çekirdekteki birikimi ve PER geninin ifadesini bastırması için bir gerekliliktir. DBT proteini, çift-zamanlı gen (Double time) tarafından kodlanır. DBT bir protein kinaz (yani hedef proteinlerini posforilleyen) bir enzim olup, PER’yi fosforile eder ve onun parçalanmasına yol neden olur. DBT aracılıklı PER protein parçalanması periyot mRNA ve PER proteini birikimi arasındaki gecikmeye katkıda bulunur. CLK ve CYK ise saat ve zemberek genleri tarafından kodlanan, PER genini aktive eden iki transkripsiyon faktörüdür. (kaynak: NobelPrize.org)
Biyolojik döngüler ve zamanlayıcılar PER, gün boyu tedricen değişerek biyolojik zamanı tutan bir madde miydi?
Hall ve Rosbash’in bu PER proteininin aslında “peryot” geninin aktivitesini bloke edebileceğini ve dolayısı ile kendi genini kapattığını düşündüler. Çünkü PER seviyeleri gece boyunca artıyor, gündüz ise azalıyordu. Protein seviyesi düşünce süreç tekrar başlıyordu. Buna negatif geribildirim döngüsü denir. Vücudunuzda kan şekeri seviyesinden, sirkadiyen ritimlere kadar her şeyi muhafaza eden biyolojik denge aynı saati kullanmaktadır. Bu tür geri bildirim sistemi, bir termostatın bir odanın sıcaklığını nasıl kontrol ettiğine benzer. Sıcaklık ayarlanan noktanın altına düşerse termostat ısıtıcıyı açar. Oda çok ısındığında, termostat ısıtıcıyı kapatır.
Biyolojik saatler her 24 saatte bir kendilerini tekrar açıp kapatmak için “peryot”ya da “zemberek” gibi saat proteinlerinden negatif geribildirim kullanırlar.
Son yirmi yılda yapılan çalışmalar, çoğu organizmanın Drosophila‘ya benzer geribildirim döngülerine dayalı saatleri nasıl kullandığını anlamamızı sağladı. Rosbash’in laboratuarı, mantar ve bitkilerden insanlara kadar pek çok saat proteininde bulunan PER proteininin PAS bölgesini tespit etti. PAS bölgeleri PER gibi eşzamanlı saat proteinlerinin, negatif geribildirim döngüsünü kontrol etmek için ortaklarıyla eşleşmesine yardımcı olur.
Bilim insanları, Drosophila ve farelerin PER ve PAS alanlarının yapılarındaki farklılıkları karşılaştırarak, moleküler saatteki protein “zmberekler”in zamana göre nasıl bir araya geldiğini öğrenmeye çalıştılar. Böyle atomik çözünürlükte sirkadiyen ritimleri anlayarak insan hastalık ve sağlığında rol oyamayabilecek birçok terapötik (iyileştirici) ve teratojenik (kötüleştirici) kimyasallar keşfedebiliriz.
Zembereklerinizi doğal ritimlerine kurun Young’ın laboratuarı yakın zamanda bir insan biyolojik saat geni olan kriptokrom 1‘de, hücresel saati erteleyen ve gece yarısından önce yatmamızı zorlaştıran yaygın bir mutasyon tespit etti. Bu kalıtsal “baykuş” geninin oldukça yaygın olduğu tahmin edilmektedir. Gelişigüzel yaz saati kış saati uygulamaları yerine, biyolojimizi etkileyen sirkadiyen ritimlere göre yatma ve kalkma zamanlarımızı ayarlamanın işyerinde verimlilik ve okulda başarı sağlayacağı düşünülmekte. Bütün bu bildiklerimizi ise önemsiz gördüğümüz minik meyve sineklerine borçluyuz.
Kaynak: The Conversation’dan değiştirilerek….
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
7 Kasım 2017
Aç kalarak daha uzun ve sağlıklı bir yaşam sürmek!
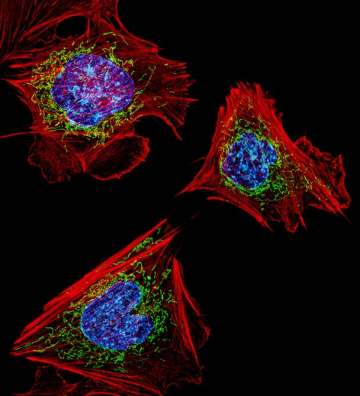
Harvard Üniversitesinden yeni bir çalışma, aralıklarla aç kalmanın yaşlanmada önemli rolleri olan mitokondrilerin ömrünü artırabileceğini gösteriyor.
Ancak, çalışmanın birçok insan hastalığı (veya sağlığı) için model organizma olarak kullanılan transparan bir nematodda (yuvarlak kurtçuk) olduğunu hemen belirteyim.
Yani bu çalışma hemen insana da uyaralanabilir diye düşünmeyelim.
Çünkü, 200 kadar farklı hücresi ve 200 trilyon kadar da hücresi ve birçok doku ve organı olan bir insanla, 1000 kadar hücresi, doğru dürüst solunum ve dolaşım sistemi olmayan, 1 mm uzunluğundaki, 15 gün ömrü olan bir toprak nematodu olan C. elegans (yani bizim kurtçuk) bir tutulamaz.
Her ne ise… yeni çalışmaya dönersek,
Önce konunun esas aktörleri olan mitokondrileri tanıyalım..
Erkek olalım kadın olalım bir kere tüm mitokondrilerimizi annemizden alırız. Bunun sabebini de tam olarak bilmiyoruz. Babamızın sperminden annemizin yumurtasına sadece kromozomlar değil mitokondriler de geçer. Ancak, her nasıl oluyorsa kromozomlar korunurken, annemizin yumurtası bu mitokondrileri bir güzel imha! eder.
Lafı bu konuda fazla uzatmayayım (ilgili birkaç yazımı burada, burada, burada, ve buradaokuyabilirsiniz).
Kısaca mitokondriler hücrelerimizin enerji santralleridir. Enerjimizin (buna ATP diyoruz) %90’ından fazlası bu organellerde üretilir. Ancak, bu santrallerde olan enerji kaçakları aynı zamanda yaşlanmamıza neden olur.
Dolayısı ile bu organaller bizler için (tabi bakteriler hariç diğer tüm canlılar için) hem birer nimet hem de lanet!
Mitokondilere dayalı “Yaşlanma Teorisi”, yaşlanmanın nasıl olduğu konusunda en önde gelen teorilerden biri. Hatta hemen tüm toplumlarda kadınların erkeklerden 5-10 yıl fazla yaşamsının sebebinin de bu organel olduğu düşünülüyor.
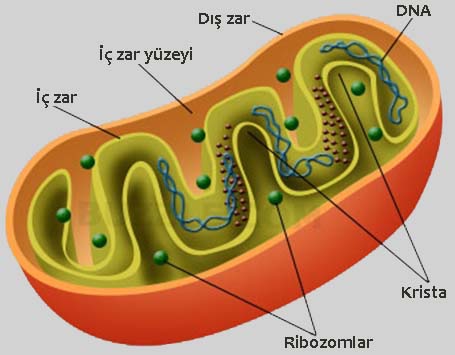
İleri yaşlarda kadınların mitokondrisi daha diri kalırken, erkeklerin mitokondirlerinde bozulmalar oluyor. Dolayısı ile yukarıda link verdiğim yazılarımdan birinde “üç ebeveynli tüp bebek” uygulamalarında neden bir erkeğin değil de bir kadının mitokondrilerinin kullanıldığı daha iyi anlaşılacaktır.
Yaşlandıkça, vücudumuzdaki hücrelerde kimisi mitokokondriyal elektrik kaçağından kaynaklanan bir seri farklı hasar türleri oluşur. Hücreler, normalde “mitofaji” (ayni mitokondrileri yemek) adı verilen bir süreç ile arızalanan mitokondrileri ortadan kaldırabilir. Bu şekilde etkili bir mitofajinin hücrelerin sağlıklı kalmasında elzem olduğu düşünülüyor.
Bu bağlamda, hücrelerin içindeki tüm mitokondrilerlerin bile çıkarılmasının hücreleri genç bir görünüme soktuğu görülmüştür.
Harvard’aki araştırma ise açlığın “sağlıklı/hasta” mitokondri dengesini sağlıklılar lehine değiştirdiğini göstermiş.
 Çalışmada aynı zamanda açlığın, yağ asidi oksidasyonunu düzenleyen ve yine bir tür organel olan peroksizomlarla mitokondriler arasındaki koordinasyonu arttığı gösterilmiş.
Çalışmada aynı zamanda açlığın, yağ asidi oksidasyonunu düzenleyen ve yine bir tür organel olan peroksizomlarla mitokondriler arasındaki koordinasyonu arttığı gösterilmiş.
Yani kısaca yaşlanma, mitokondrilerin sağlıklı mı yoksa hasta mı olduğu ile ilişkilidir. Burada, açlıkla aktive olan bir enzim (AMPK) ve beslenmede kısıtlama, sağlıklı mitokondrilerin artışına ve peroksizomlarla daha iyi bir ilişki kurmalarına neden oluyor.
Kaynak: Cell Metabolism
Count your age by friends, not years. Count your life by smiles, not tears (Hayatını gözyaşı ile değil gülümsemekle, yaşını yıllarla değil, arkadaş sayınla say. -The great singer and song-writer John Lennon)
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
25 Ekim 2017
Kanser: Metabolik Bir Yeniden Programlama…
 Kanser hücreleri kontrolsüz ve hızlı çoğalırlar. Bilim dünyasında kanser hücreleri “freni patlamış, gaz pedalı basılı kalmış araba”ya benzetilir. Dolayısı ile depoda yakıt olduğu sürece araba son sürat hızla gider. Tabi, bunu yaparken çevresindeki hücrelere de zarar verir. Ta ki duvara toslayana, yani ölüme sebep verene kadar.
Kanser hücreleri kontrolsüz ve hızlı çoğalırlar. Bilim dünyasında kanser hücreleri “freni patlamış, gaz pedalı basılı kalmış araba”ya benzetilir. Dolayısı ile depoda yakıt olduğu sürece araba son sürat hızla gider. Tabi, bunu yaparken çevresindeki hücrelere de zarar verir. Ta ki duvara toslayana, yani ölüme sebep verene kadar.
Hızlı çoğaldıklarından dolayı, kanser hücreleri daha çok yemeye ve içmeye ihtiyaç duyarlar. Dolayısı ile kanser hücresine hiç doymak bilmeyen “obez” birşey gibi bakabiliriz. Bu nedenle, kanser hücreleri çoğalmalarını desteklemek için proteinleri yapan amino asitler, DNA ve RNA’yı yapan nükleotidler ve yağlar gibi hücrenin gerekli yapı taşlarını tedarik etmek için metabolik ayarlamalar yaparlar.
Normal hücrelerden farklı olarak, kanser hücreleri yüksek seviyede glükoz (kan şekeri) kullanırlar. Normal hücreler oksijen varlığında glükozu tamen parçalarlarken, kanser hücreleri oksijen olsa da olmasa da glükozu kısmen parçalarlar. Oksijen yokluğuna fazla dayanamayan normal hücrelerin tersine, kanser hücreleri oksijensiz ortamda da rahatça büyüyüp çoğalırlar. Hatta kanser hücreleri oksijensiz ortamda daha çok glükoz tüketirler (Warburg Etkisi).
Kanser hücrelerinin glukozu tam parçalamamalarının tabi bir sebebi vardır: büyümeleri için gerekli maddeleri sağlamak. Dolayısı ile, glükozun kısmen parçalanmasından açığa çıkan maddeler kanser hücrelerin büyümesi için kullanılır.
Kanser hücrelerinin “metabolizma” dediğimiz yeme-içme, enerji ve yapı taşı oluşturmak için başvurdukları bu yeniden programlama olayını şimdi biraz açalım…
Kanserli hücrelerinin değişik bir metabolizma sergilediği fikri yeni değil…
Bu olay ta bundan nerede ise bir asır önce Alman biyokimyacı Otto Warburg tarafından gösterildi ve dolayısı ile “Warburg Etkisi” olarak da bilinmektedir. Warburg geliştirdiği kalorimetrik tekniklerle (besinlerin yakılmasından ortaya çıkan ısı ve enerjinin ölçülmesi) tümör hücrelerinde ve normal dokulardaki hücrelerde enerji üreten iki önemli yolun enerji oranlarını karşılaştırdı. Bu yolaklardan birincisi 6 karbonlu glükozun 3 karbonlu iki piyruvata kısmı parçalanmasını sağlayan ve hücrenin sitozol dediğimiz sıvı kısmında yer alan “glikoliz” yolağıdır.
Glikoliz?Glikoliz, “şekerlerin erimesi veya bölünmesi” anlamına gelip, şekerlerdeki enerjiyi açığa çıkarma sürecidir. Glikolizde, glukoz (altı karbon şeker) üç karbonlu iki piruvat molekülüne bölünür. Bu yolakta iki molekül ATP (serbest enerji içeren molekül), iki molekül piruvat ve iki molekül “yüksek enerjili” elektron taşıyan NADH üretilir. Glikoliz oksijen olsun veya olmasın meydana gelebilir. Oksijen varlığında, glikoliz hücresel solunumun ilk aşamasıdır. Oksijenin bulunmaması durumunda, glikoliz, hücrelere fermantasyon süreci boyunca az miktarda ATP yapabilmelerini sağlar. Glikoliz, hücrenin sitoplazmasında gerçekleşir.
İkincisi ise hücrelerde enerji dinamosu olarak rol alan ve enerjimizin (yani ATP’mizin) % 90’ını sağlayan mitokondri denen organelde peş peşe gerçekleşen 3 “hücresel solunum” yolağıdır (Krebs Döngüsü + Elektron transfer Zinciri ve Oksidatif Fosforilasyon). Krebs Döngüsü, glikoliz yolağı ile kısmen parçalanmış ürünün yani piruvatın tamamen parçalandığı bir döngüdür.
Krebs Döngüsü?Trikarboksilik Asit (TCA) Döngüsü veya Sitrik Asit Döngüsü olarak da bilinen Krebs Döngüsü hücresel solunumun ikinci evresidir. Yediğimiz yiyecek ve içeceklerdeki karbonhidratlar, proteinler ve yağlarda bulunan kullanılabilir enerji esas olarak bu döngü ile salınır. Sitrik asit döngüsü doğrudan oksijen kullanmamasına rağmen, oksijen yokluğunda çalışmaz. Oksijen varlığında glikolizin son ürünü olan 2 adet 3 karbonlu piruvatın her biri mitokondriye taşınır ve orada her bir piruvat birer asetil CoA denen 2 karbonlu enerjetik moleküle çevrilir. Asetil CoA Krebs Döngüsü ile tamamen parçalanır. Her bir asetil CoA’nın parçalanması ile 2 CO2, 3 NADH ve 1 FADH2 ve 1 ATP ortama salınır. Yüksek enerjili elektronları taşıyan NADH ve FADH2 daha sonra bu elektronlarını Elektron Transfer Zincirine aktarır. Böylece NADH ve FADH2’den gelen elektronların transferi ile bir proton gradienti oluşur ve bu gradiyent vasıtası ile daha çok ATP ürteilir (oksidatif fosforilasyon).
Warburg, oksjen yokken normal hücrelerin enerji bakımından zayıf bir yolak olan glikolizi pek yapamadıklarını, kanser hücrelerine bu etkinin görülmediğini ve hatta oksijensizlik durumunda bu hücrelerin glikoliz aktivitesinin arttığını gösterdi. Buna aerobik glikolizis adı verildi.
Bu durum bugün klinikte kanser tümörlerinin işaretelenip belirlenmesinde bile kullanılmaktadır. Hastalara enjekte edilen ve bir glükoz analogu olan flurodeoksiglukozözllikle tümörlerde birikir. Çünkü kanser hücreleri glükozu normal hücrelere göre nerede ise 20 kata daha fazla kullanır. Ancak glükozdan farklı olarak bu analog madde parçalnmaz ve dolayısı ile tümörlerde birikir. PET scan olan pozitron emisyon tomografi cihazı (röntgen gibi bir cihaz) kullanılarak hastanın vücudunda tümör olup olmadığı belirlenir.

“Aerobik glikoliz” genel olarak kanserin 10 işaretinden biri sayılmaktadır. Diğerleri mi?

Warburg, kanserli hücrelerin işlevsiz mitokondrilere sahip olduğunu ve dolayısıyla enerji için glikolitik metabolizmaya ihtiyaç duyduklarını öne sürdü. Ancak, daha sonra birçok kanser hücresinin mitokondriyal solunumu gerçekleştirebildiği anlaşıldı. Dolayısı ile organeller işlevsel olmalı idi. Ayrıca, mitokondrisi olmayan bazı hücreler (örn, kırmızı kan hücreleri) glikolitik metabolizma ile kanser hücreleri gibi yüksek seviyede glikoz tüketebiliyordu.
Alternatif bir hipotez ise, artan glikolizin kanser hücrelerinin hızlı hücre çoğalması için gerekli olan temel metabolik prekürsörleri sağlamasındaki rolü idi. Örneğin, glikolizin ara maddeleri, nükleotid ve DNA biyosentezi için öncül üreten pentoz fosfat yolunaaktarılabilirdi. Bu ara maddeler ayrıca, nükleotid ve protein sentezi için gerekli olan çeşitli amino asitleri yapmak için kaynak sağlayabilir.
Son yıllarda, kanser hücrelerinin, glikolizin son aşamasını katalize eden, düşük aktiviteli bir piruvat kinaz formu (PMK2) taşıdıkları bulgusu, hücre çoğalmasında glikolitik ara maddelerin kritik rolünü daha da desteklemektedir.
Glikoliz olan yüksek bağımlılığına rağmen, çoğu kanser hücresi çoğalmak için aktif mitokondriyal solunuma da gerek duyar. Bu, enerjiye olan ihtiyaçtan değil, proteinlerin yapısına girmesinin yanı sıra nükleotid sentezinin bir öncüsü olan amino asit aspartata olan ihtiyaçtan kaynaklanır. Bu nedenle, fonksiyonel mitokondrileri olmayan yani hücresel solunum yapamayan ve de dolayısı ile aspartat üretemeyen kanser hücrelerinin aspartat açlığı çektiği ve sırf bu nedenle öldükleri görülmüştür. Tabi bu durum sadece aspartat için de geçerli değil. Birçok, diğer amino asit ve lipid de mitokondrideki Krebs Döngüsü ara ürünlerinden oluşur ve buradan sitoplazmaya geçerler.
Kanser hücrlerinde glukozun sadece bir kısmı Krebs Döngüsüne katılır. Geri kalan kısmı laktik asite çevrilir. Dolayısı ile kanser tümötlerinin çoğu bol miktarda laktik asit ürettiğinden, asidik bir çevreye sahiptirler. Son yıllarda kanser hücrelerinin bu asit çevresini hedef alan terapötik yaklaşımlar da bulunmaktadır.
 Kanserde Metabolik Yolakları Hedefleme
Kanserde Metabolik Yolakları Hedefleme
Kanser hücrlerinde yeniden ayarlanan metabolik yolların birçoğu yeni antikanser tedavileri için hedef görevi görebilir.
Metabolizmaya dayalı kanser tedavileri geliştirmeye yönelik ilk girişmler DNA sentezinin bloke edilmesine odaklı idi. Bir vitamin olan folatın uygulanmasının DNA’nın yapı taşları olan nükleotidlerin oluşması için kritik öneme sahip olduğu görüldü. Hatta folat alan hastalarda löseminin (kan kanseri) şiddetli bir şekilde ilerlediği gözlendi. Sentetik yani hücreler tarafından parçalanmayan folat analogları (anti-folat) kullanıldığında kanserin önlendiği görüldü. Bugün anti-folat ilaçlar (örn., Metotreksat) meme ve kan kanserleri için standart kemoterapinin bir parçası olarak rutin olarak kullanılmaktadır.
Daha en başta kanser hücrelerinin kontrolsüz büyüyüp çoğaldıklarını söylemiştik. Bunun sebebi hücrelerin yeme içmesini düzenleyen ve büyüyüp bölünmesini sağlayan genlerin kanser hücrelerinde mutasyonlarla sıvanmış olmasıdır. Dolayısı ile bu genleri kontrol eden elemanlar (büyüme faktörleri, vs) görevlerini yapamaz.
Örnek mi?
Kanser hücrelerinde insüline tepki olarak glükoz metabolizmasına aracılık eden fosfoinositid 3-kinaz (PI3K) yolağı; Normalde PI3K sinyali yolağı ile insülin hormonu, kas ve yağ gibi dokulardaki glikoz alımını arttırır. Ancak, birçok kanser hücresinde, PI3K yolağının çeşitli bileşenleri (transkripsiyon faktörleri, vs) mutasyona uğramışlardır ve dolayısı ile bu hücrelerde insülinden bağımsız olarak çalışan ve yüksek seviyelerde glükoz alımını sağlayan anormal bir durum vardır.
Kısaca kanser kaostan beslenir! ve normal hücrelerin tersine bu hücrelerin ne yapacağını kestiremezsiniz. Çünkü kanser hücrelerinde yavru ebeveynine, ebeveyni atasına benzemez. Bunun nedeni her yeni doğan bir kanser hücresi farklı mutasyonlar taşır. Bu nedenle kanserler tedaviye belirgin şekilde farklı yanıtlar gösteren farklı tümör tiplerine sahip oldukça heterojen bir hastalıklardır.
Sinyal bileşenlerine ilaveten, metabolik enzimlerin mutasyona uğraması ve doğrudan tümör oluşumuna katkıda bulunabileceğine dair de artan kanıtlar vardır. Örneğin, Krebs döngüsü enzimlerinden süksinat dehidrogenaz (SDH) ve fumarat hidrataz (FH) enzimlerindeki genetik kusurlar nadir görülen böbrek ve endokrin kanserlerine yol açar. Bu enzimleri kodlayan genler klasik tümör baskılayıcılar gibi davranır; bir mutant alel genellikle kalıtsaldır, daha sonra somatik hücrelerde ikincisinde oluşacak bir mutasyon kanser oluşumuna neden olur. Bu enzimlerin inaktif olması veya hiç olmaması, süksinat ve fumaratın birikmesine neden olur. Bir başka Krebs döngüsü geni, izositrat dehidrogenaz(IDH), bir onkogen (kanser geni) gibi davranıyor; tek bir aleldeki bir mutasyon bile kanser oluşumu için yeterlidir. Ancak burada mutasyon, enzimde aktivite kaybına neden olmayıp, onun işlevini değiştirir: 2-hidroksiglutarat (2-HG) olarak adlandırılan alternatif bir metabolitin sentezine sebep olur.
İnsan serumunda yaklaşık 5000 metabolit bulunur ve farklı kanserler bu metabolitlere farklı bağımlılıklar gösterebilir. Metabolik bozukluklarda metabolit birikimi sık görülür. Bazı metabolitlerin birikiminin neden toksik olduğu belli değildir. Bu metabolitlerin (örn., süksinat, fumarat ve 2-HG) birikiminin, normal hücrelerin epigenetik programını bozarak (yani DNA metilasyonunu değiştirerek) kansere neden olduğu düşünülmektedir.
Kanser hücrelerinin yukarıda anlattığımız garip metabolizmasını etkileyen bir diğer önemli faktör, içinde yaşadıkları ortamdır. Hızla büyüyen tümörlerdeki kanser hücreleri oksijen ve besinlere karşı açlık çekerler ve toksik atıklara maruz kalırlar. Bunun nedeni, besin tüketiminde arzın talebi karşılayamaması ve işlevsiz damar yapısının ortaya çıkmasıdır.
Buna uyum için, kanser hücreleri glikolitik enzimleri ve glükoz taşıyıcılarını ve düşük oksijenle ortaya çıkan hipoksi indüklenebilir faktörü (HIF) adı verilen bir transkripsiyon faktörünü oldukça aktive ederler. Kanser hücrelerinin glikolizi esas yolak olarak kullanması, hücrelerin mitokondriyal solunuma ve dolayısıyla oksijene bağımlılığını azaltır.
Düşük oksijen, moleküler oksijen gerektiren metabolik enzimlerin işlevini de etkiler. Örneğin lipid desatürazlar yağ asiti zincirlerini “doymamış” hale getiren karbon-karbon çift bağlarını oluşturmak için oksijen kullanır. Bu doymamış yağ asitleri, hücre zarının kritik bileşenleri olup, onun akışkanlığına ve geçirgenliğine katkıda bulunur. Dolayısı ile tümörlerdeki düşük oksijen seviyeleri, doymamış yağ asitlerinin oluşumunu engelleyerek, doymuş yağ asitlerinin birikmesine sebep olur. Bu da hücre zarının molekülleri etkili taşımasını önler. Bu dengesizliğin üstesinden gelmek için, birçok kanser hücresi ihtiyaç duydukları doymamış yağ asitlerini yerel çevrelerinden, bazı durumlarda yakındaki lipid zengini adipositlerden (yağ hücreleri) transfer edilebilir. Dolayısıyla, kanser hücrelerini öldürmek için düşük oksijen koşullarında lipid satürasyonu (doygunluğu) ve taşımasının hedeflenmesi potansiyel teşkil edebilir .
Klinikte kanser metabolizmasının hedef alındığı bir başka örnek de kendi laboratuvarımızda klonlayıp ürettiğimiz ve kan dolaşımında asparajin amino asitini yıkan bir enzim olan asparajinaz uygulamasıdır.
Kanser hücrelerinin genleri mutasyonlarla sıvandıklarından, birçok enzimi yapan genler bu hücrelerde normal işlevsel enzimleri veya proteinleri yapamazlar. Dolayısı ile kanser hücreleri bu enzimler tarafından yapılan maddeleri çevrelerinden almak zorundadır. Bu maddeler kanser hücrelerine iki şekilde sağlanır: yiyecek ve içeceklerden veya normal hücreler tarafından yapılıp kana salınanlar. Çevredeki bu maddeleri ortadan kaldırırsanız, normal hücrelere birşey olmazken (çünkü onlar o maddeleri zaten kendileri yapabiliyor), kanser hücreleri aç kalır.
Yukarıda örneğini verdiğimiz asparajinde de durum budur. Bu amino asit normal hücreler tarafından ihtiyaç duyuldukça yapılır. Çünkü bu hücreler bu amino asiti yapan işlevsel bir asparajin sentaz enzimine sahiptir. Ancak, kanser hücrelerinde bu enzim mutant olduğu için işlev yapamaz ve dolayısı ile asparajin amino asiti sentezlenemez. Kanser hücreleri bu amino asiti çevrelerinden (tümör mikroçevresi) almak zorundadırlar.
Obezite ve insülin direnci genellikle kanser riskinin artması ile ilişkili olduğundan, son zamanlarda metformin ve fenformin gibi antidiyabetik ilaçlar antikanser etkileri olup olmadığı araştırılmıştır. Metformin ile tedavi edilen insanlarda dolaşımdaki insülin düzeylerinde bir azalma olmaktadır. Bilindiği gibi insülin, yukarıda bahsttiğimiz PI3K yolu boyunca kanser hücresi büyümesini ve besin alımını teşvik etmektedir.
Kanserli hücre metabolizması üzerine yapılan araştırmalar ve halihazırda kullanılan metotreksat ve asparaginaz gibi ilaçlara dayanan heyecan verici yeni terapötik yaklaşımlar kanser hücrelerindeki metabolik zayıflıkların daha iyi anlaşılmasını sağlayacaktır.
 Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Hikmet Geçkil Illinois Institute of Technology’de Moleküler Biyoloji alanında doktora derecesini aldı. Ben Gurion Üniversitesi’nde CHI bursu ile doktora sonrası araştırma yaptı. Harvard Üniversitesi ve Massachusetts Teknoloji Enstitüsü (MIT)'de Fulbright burslusu olarak çalıştı. Araştırma alanı Genetik Mühendislik olup, halen İnönü Üniversitesi Moleküler Biyoloji ve Genetik Bölümünde öğretim üyesidir.
Kaydol:
Yorumlar (Atom)





