Metabolizmayı bozarak otoimmün hastalıkları tedavi etmek
Otoimmün (vücudun kendine karşı bağışıklık geliştirmesi) ve enflamatuar (iltihabi) hastalıklar, bağışıklık hücrelerinin uygun olmayan ve uzun süreli aktivasyonunun neden olduğu durumlardır. İltihabi mediyatörlerin sürekli olarak devam eden üretimi doku hasarına neden olur.
Dimetil fumarat (DMF) fumarik asitin bir metil esteri olup, bir çeşit otoimmün cilt hastalığı olan psoriasis tedavisinde kullanılmaktadır. 2013 yılında DMF, yine otoimmün bir hastalık olan multipl sklerozun (MS) tedavisi için onaylanmıştır. Bununla birlikte, DMF'nin etki mekanizması bilinmemekte idi.
Dimetil fumarat (DMF) fumarik asitin bir metil esteri olup, bir çeşit otoimmün cilt hastalığı olan psoriasis tedavisinde kullanılmaktadır. 2013 yılında DMF, yine otoimmün bir hastalık olan multipl sklerozun (MS) tedavisi için onaylanmıştır. Bununla birlikte, DMF'nin etki mekanizması bilinmemekte idi.
Bu hafta bilim adamları DMF'nin yararlı etkilerinin, gliseraldehid-3-fosfat dehidrogenaz (GAPDH) enzimini inhibe etmekle ilişkili olduğunu gösterdi. GAPDH, glikoz metabolizmasının ana yolaklarından olan glikolizde merkezi bir enzimdir.
Bu çalışma bize şunu gösteriyor: bağışıklık yanıtlarını modüle etmek için metabolizma hedeflenebilir.
Genom güdümlü kanser tedavisi bir aldatmaca mı?
Kanserin ilerlemiş haline sahip hastalar için seçenekler tükenirken, birçok kanser merkezi şu anda şu umudu sunuyor: Tümörünüzün genomu dizilensin ve doktorlarımız kanserinizin zayıf noktasını hedefleyen bir ilaçla sizi tedavi etsin.
Ancak, bu verilen sözün abartılı olduğunu söyleyen bilim insanları da var. Geçen hafta, alandaki iki önemli ses, Şikago'daki Amerikan Kanser Araştırmaları Derneği'nin yıllık toplantısında kişiye "özel onkoloji" olarak adlandırılan bir konuda karşı karşıya geldiler. Genom tabanlı kanser tedavileri konusundaki tartışmalar bilim insanlarını da bölmüş durumda.
Ancak, bu verilen sözün abartılı olduğunu söyleyen bilim insanları da var. Geçen hafta, alandaki iki önemli ses, Şikago'daki Amerikan Kanser Araştırmaları Derneği'nin yıllık toplantısında kişiye "özel onkoloji" olarak adlandırılan bir konuda karşı karşıya geldiler. Genom tabanlı kanser tedavileri konusundaki tartışmalar bilim insanlarını da bölmüş durumda.
Bir hastaya maliyeti 1 milyon dolarları bulan bu tür tedavilerin parayı götürdüğü, ancak tama olarak ne getirdiği belli değil.
CRISPR ile yeni nesil teşhisler
Bulaşıcı hastalıkların hızlı ve doğru bir şekilde tanımlanması, klinik bakım ve hastalıkların yayılmasını sınırlamak için elzemdir. Prokaryotların (bakteri ve arkea) CRISPR ve CRISPR ile ilişkili (Cas) proteinlerin aracılık ettiği kalıtsal adaptif bağışıklığa sahip olduğunun keşfi, gen düzenlenmesi başta olmak üzere moleküler biyolojide devrim niteliğinde ilerlemelere yol açmıştır.
Bu hafta araştırmacılar Zika virüsü, Dengue virüsü ve insan papilloma virüsünün (HPV) tespiti, bulaşıcı olmayan enfeksiyon hastalıkları ve akciğer kanseri hastalarında dolaşımdaki DNA'larda gen mutasyonlarının saptanmasında CRISPR-Cas'ın moleküler teşhis aracı olarak kullanılması konusunda perspektifler sundular.
Henüz yeni olan CRISPR-Cas teknolojisi; meyve-sebze üretimi, içerik zenginleşitirmesi, mikroplara ve yukarıda belirtildiği gibi virüslere karşı mücadele için yakın zamanda kullanılacağı düşünülmektedir. Ancak, hedef dışı değişikliklere sebep olmasından dolayı bu teknoloji ile insanda bazı genetik hastalıkların düzeltilmesi (özellikle tek genle geçen) konusu henüz bilinmeyen bir gelecekte olabilecektir.
Mitokindrinin Orijini!
Kırmızı kan hücrelerimiz hariç, mitokondiriler hemen tüm hücrelerimizde bulunurlar. Enerjimizin % 90'ını onlara borçluyuz. Dolayısı ile bu organellere "hücrenin enerji santralleri" olarak da bakılabilir. Oksijenli solunumu onlara borçluyuz. Bazı yaygın görüşlere göre yaşlanmayı da...
Her ne ise konumuz dönersek...
Biyoloji ders kitaplarında mitokondrilerin orijin olarak bakteri oldukları yazılıdır. Yani bundan kaçyüz milyon yıl önce, bir bakteri o zamana kadar oksijensiz solunum yapan bir hücrenin içine girmiş ve orada simbiyotik yada mutualistik bir ilişki ile mitokondriye evrilmiş. Bazı görüşlere göre ise bu organeller hücre içi zorunlu parazitler olan ve alfaproteobacterial grubuna dahil Riketsialardan orijin almışlardır.
Mitokondrinin alfaproteobacterial atalara sahip olduğuna dair güçlü filogenetik kanıtlara rağmen, alfaproteobakteri arasında en yakın akrabalarının hangi bakteriler olduğu ise bilinmemektedir.
Bu haftaki Nature dergisinde, mitokondrilerin Rickettsiales'den veya şu anda tanınan herhangi bir alfaproteobacterial soyundan evrimleşmediği, daha ziyade alfaproteobakterilerin filogenetik dallanmasından önce proteobakteriyel bir soydan evrimleştiğini rapor ettiler.
Mitokondrilerin hücresel işlevleri ve orijinleri konusu daha birçok bilinmeyene sahip. Bana göre, nukleustan (çekirdek) sonra hücrenin en önemli organelleri. Hücre ölümübnedn yaşamına kadar her fizyolojik süreçte rolleri var. Genç bir araştırmacı olsam, kesinlikle bu organelleri çalışırdım. Merak ettiğimse, acaba bu orgaenlleri uygun hücre dışı ortamlara koysak bakteri gibi çoğalabilirler mi?
Detayları ile insan telomeraz enzimi
Telomeraz önemli bir enzim. Hücrelerinde uygun miktarda bulunursa ömrün uzuyor. Dolayısı ile hayvanlarda ömür uzatma çalışmalarında en çok hedef alınan bir enzim. Bazen enzime "yaşam pınarı" deniyor.
Peki bu enzimin işlevi ne?
Vücut hücrelerimiz en fazla 50-60 kez bölünebiliyor ve daha sonra kromozom uçlarında oluşan erozyondan kaynaklanan kaotik bir durumla (Hayflick Limit) karşılaşıyorlar ve bu durumda kendi kendilerini imha ediyorlar (apoptoz).
Bunun sebebi, kromozom uçlarımızda "telomer" adı verilen ve çok sayıda tekrarı olan kısa bir DNA dizisinin giderek kısalması. Telomeraz, bu kısalmayı önlüyor, daha doğrusu bu tekrarları sentezliyor. Diğer bir ifadeyle, telomeraz enzimi Telomeraz enzimi, kromozomların uçlarında tekrarlayan DNA dizilerinin koruyucu başlıklarını kararlı halde sürdürüyor. Bu nedenledir ki, çoğu kanserlerde hücreler "ölümsüzdür". Çünkü, kanser hücrelerinde yüksek telomeraz aktivitesi vardır.
Ancak, ne yazık ki, hücrelerimizde telomeraz enzimi çok az bulunuyor ve yaşla da nerede ise sıfırlanıyor. Çok az bulunduğundan, bu enzimin yeterli miktarda saflaştırılması ve kristal hale getirilerek yapısının araştırılması bugüne kadar mümkün olmadı.
Bu haftaki Nature'da telomerazın yapısı yüksek çözünürlükte (7-8 Angström) rapor edildi. Bu çözünürlük, dondurulmaya dayalı elektron mikroskopi tekniği ile yapıldı. Aşağıdaki basit çizimle de anlatıldığı gibi, enzim iki ana bölgeden oluşmakta:

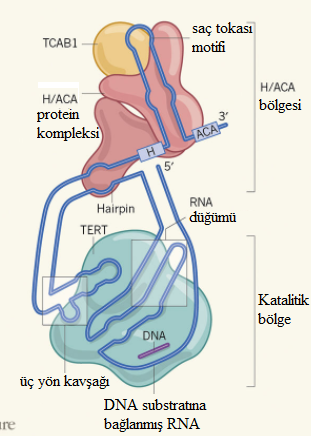
Telomeraz enziminin şematik yapısı: İki ana bölgeden oluşan enzim, 6 adet proteinle sıvanmış bir büyük RNA içermektedir. Her iki bölge içine uzanmış ve proteinler için bir iskele görevi gören uzun bir RNA (mavi) bulunmaktadır. Üst bölge, telomeraz enziminin bileşenlerinin bir araya gelmesini kolaylaştırır ve nukleustan (çekirdek) enzimin çıkmasını engeller. Alt bölge enzimin katalitik bölgesini içerir. Katalitik bölge, bir revers transkriptaz (RT) olan TERT proteinini içerir. RT, RNA'yı kalıp alarak DNA sentezler.

İnsan telomeraz enziminin ilk görselleştirilmiş şekli. Telomeraz büyük bir enzim kompleksinden oluşmaktadır (resimde aşağıdaki yapı). Bu enzim, kromozomlarımızın (mavi renkli) uçlarını (yeşil renkle gösterilmiş) düzenler. Enzimin kanser ve yaşlanmadaki rolü nedeniyle bu çalışmanın ilaç tasarımı için bir atılımı temsil edeceği düşünülmektedir. (grafik: Janet Iwasa)
Bu çalışma ile ilgili bir video kayıt aşağıda izlenebilir:
https://youtu.be/iySP8A5Yoxc
Biraz tarihçe... Telomeraz enzimi 30 yıl kadar önce keşfedildi (LİNK). İlk keşfedildiği canlı bir protozoa (tek hücreli ökaryot) olan Tetrahymena idi. İlginç olan, ilk katalitik RNA da bu canlıda keşfedildi. Telomeraz enzimi çalışması 2009 yılında, katalitik RNA çalışması ise 1989 yılında Nobel Ödülüne layık görüldüler.
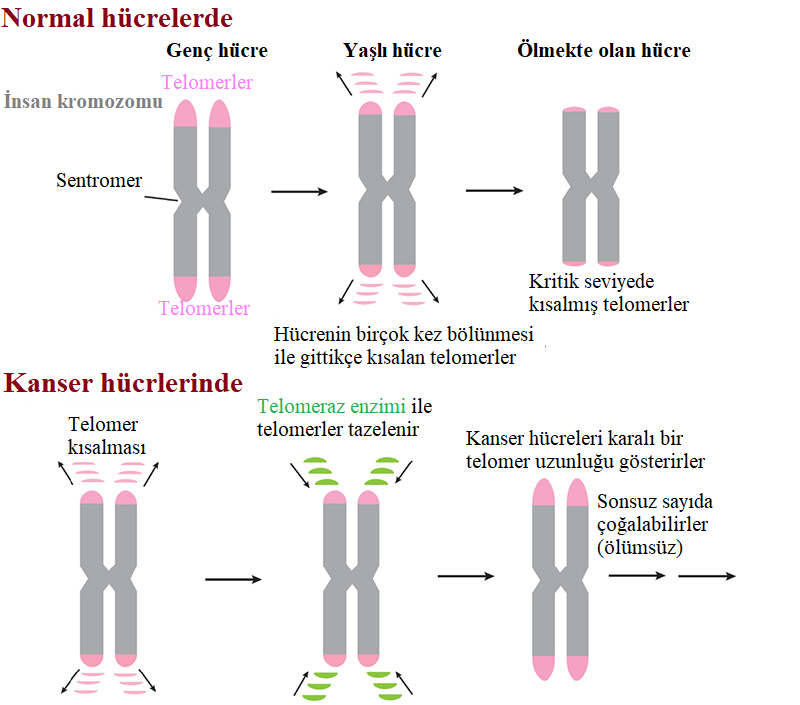
Hücreler yaşlandıkça telomerleri kısalır. Çoğu hücrelerimizde telomerlerin uzatılması için telomeraz yoktur. Böylece, telomer kritik derecede kısaldığında hücre büyümesi durur ve hücreler ya ölür ya da yaşlanır. Kanser hücrelerinde telomeraz aktif kalır ve telomerleri yeniler. Bu durum, kanser hücrelerinin sabit bir telomer uzunluğunu muhafaza etmesine ve sonsuza kadar yaşayabilmesine olanak tanır.
Bilim adamları, insanlarda ve diğer çok hücreli organizmalarda telomerazın yetişkin hücrelerde bulunmadığını, yalnızca embriyoda ifade olduğunu keşfettiler. Bu, yetişkinlerde hücrelerin büyümeleri ve bölünmeleri için önceden belirlenmiş bir yeteneğe sahip oldukları ve belli bölünmeden sonra ölecekleri anlamına gelir. Birçok bilim adamı, kısalmış telomerlerin yaşlanmanın önemli bir nedeni olduğuna inanmaktadır.
Bu hafta yapılan çalışmada enzimin yüksek çözünürlükte görünümünü ortaya koyan dondurulmaya-dayalı elektron mikroskopi tekniği (Cryo-electron microscopy) de geçen yılın (2017) Nobel Kimya ödülüne layık görülen bir çalışma oldu. Küçücük ve ancak mikroskopta görebildiğimiz bir canlının muhteşem yaşam moleküllerinin keşfi ve onları görüntülemek için icat edilen cihazlar bilimin nasıl sonsuz bir uğraşı olduğunu gözler önüne seriyor...



Hiç yorum yok:
Yorum Gönder