Pfizer-BioNTech
- BNT162b2 [mRNA]
- ((4-hidroksibütil)azanedil)bis(heksan-6,1-diil)bis(2-heksildekanoat) (ALC-0315)
- 2-[(polietilen gikol)-2000]-N,N-ditetradeasetilamid (ALC-0159)
- distearoilfosfatidilkolin (DSPC)
- kollesterol (bir nevi yağ ve hormon öncülü)
- potasyum klorür (bir nevi tuz)
- monobazik potasyum fosfat (enerji, fosforilasyon molekülü ve tampon)
- sodyum klorür (bildiğimiz tuz)
- dibazik sodyum fosfat .2H2O (enerji, fosforilasyon molekülü ve tampon)
- sükroz (çay şekeri)
- enjekte etmek için hepsi su
Aktif içeriği
- mesajcı ribonükleik asit – BNT162b2 [mRNA]
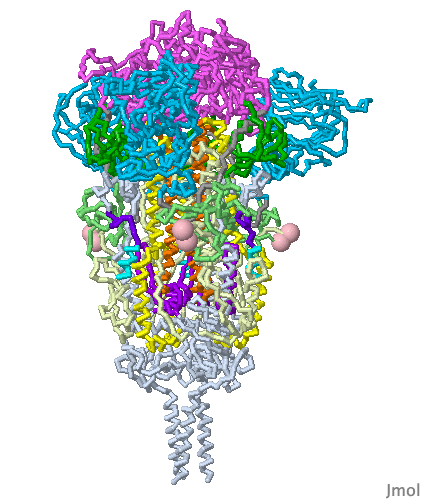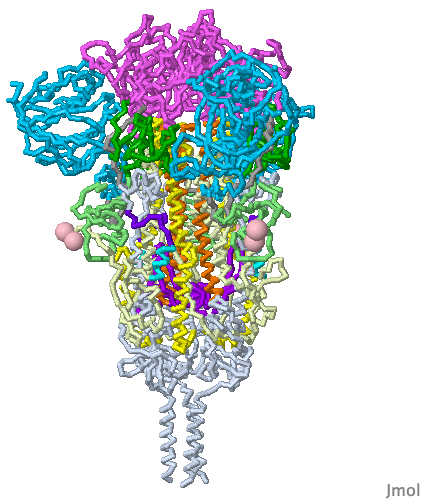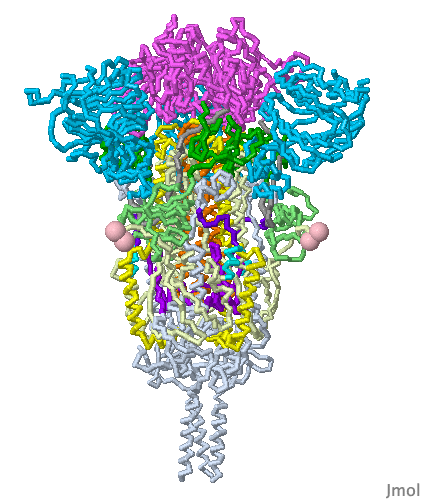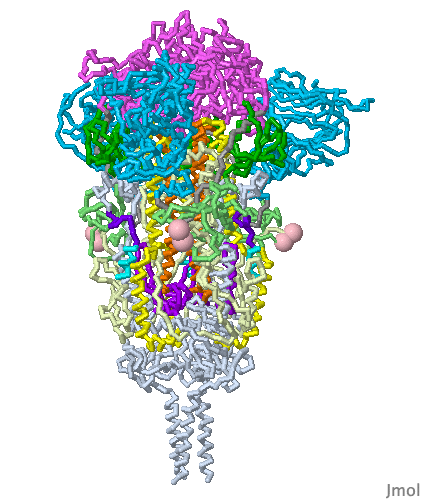
Bu mRNA, vücudun koronavirüs spike proteinleri yapmak için kullandığı ve bizi gerçek koronavirüse karşı koruması gereken bir bağışıklık tepkisini tetikleyen ünlü mRNA veya haberci (mesajcı) RNA’dır. İlginç bir şekilde, Pfizer’in mRNA’sı, doğal olarak oluşan mRNA’dan biraz farklıdır (urasil (U) nükleosidleri ile modifiye edilmiştir ve herbirinin yerine psödo(sahte) urasil yerleştirilmiştir. Bu hile, 15 yıldan daha uzun bir süre önce keşfedilen bir numaradır. Neye yarar? Bağışıklık sistemimizin yabancı mRNA’yı Spike proteinlerini yapmak için kullanılmadan önce tanımasını ve yok etmesini engeller.
Lipid nanopartikül kaplaması
- ((4-hidroksibütil)azanedil)bis(heksan-6,1-diil)bis(2-heksildekanoat) (ALC-0315)
- 2-[(polietilen gikol)-2000]-N,N-ditetradeasetilamid (ALC-0159)
- distearoilfosfatidilkolin (DSPC)
- kollesterol
Spike proteinleri yapmak için mRNA’nın hücrelerimizin içine girmesi gerekir ve hücrelerimizde mRNA gibi molekülleri iten yağlı zarlar bulunur. Bu nedenle aşı, mRNA’yı kaplayan dört farklı lipidle (hücre zarlarına daha çok benzeyen uzun, yağlı moleküller) sahiptir. Nanometre boyutunda baloncuklar oluştururlar ve bu nedenle ‘lipid nanopartiküller‘ olarak bilinirler.
Pfizer’in lipid kombinasyonu, son on yıldır terapötikler (ilaçlar) için farklı lipid kombinasyonlarını araştıran Acuitas adlı bir şirket tarafından geliştirilmiştir. Dört farklı lipidin bu kombinasyonu, Pfizer ve Acuitas tarafından mRNA’nın hücrelere alınmasında en etkili olarak değerlendirildi.
Lipidlerin üçü (ALC-0315, ALC-0159 ve DSPC) sentetik olarak tasarlanmıştır ve daha önce birkaç terapötik tedavide kullanılmıştır, dördüncüsü (kolesterol) ise vücudumuzun halihazırda birkaç gram içerdiği bir moleküldür.
Tamponlar (asit-baz dengeleyicileri)
- potasyum klorür
- monobazik potasyum fosfat
- sodyum klorür
- dibazik sodyum fosfat .2H2O
Aşıdaki mRNA (aslında bunlar vücudumuzdaki proteinleri de kodlayan molekül çeşitleridir) – asitliğe veya pH’a oldukça duyarlıdır. Tuzlar, pH tamponları olarak hareket edebildikleri ve bir çözeltinin fazla asidik veya bazik hale gelmesini önledikleri için eklenir. Pfizer aşısındaki dört tuz, pH’ı zaman içinde kararlı tutmak için tasarlanmıştır. Tuzlardan ikisi (monobazik potasyum fosfat ve dibazik sodyum fosfat dihidrat) ayrıca bazı farmasötik tedavilerde, gübre ve gıda katkı maddeleri olarak kullanılırken, potasyum klorür ve sodyum klorür (sofra tuzu) yaygın, doğal olarak oluşan maddelerdir.
Kararlaştırıcı şeker
Özellikle düşük sıcaklıklarda depolandığından, diğer bileşenleri kararlı tutmak için aşıya sükroz (çay şekeri) eklenmiştir.
Çözücü
Son olarak, bu bileşenlerin hepsinin sıvı halde olması gerekir, bu nedenle bir aşının bunları eritecek ve karıştıracak bir şeye ihtiyacı vardır. Neyse ki su, bunu yapmak için mükemmel moleküldür, bu yüzden aşıya eklenen son maddedir.
Moderna
- mesajcı ribonükleik asit (mRNA)
- SM-102
- polietilen glikol [PEG] 2000 dimyristoylgliserol [DMG]
- kollesterol
- distearoilfosfatidilkolin (DSPC)
- trometamin (diğer adı ile Tris tamponu)
- tromeamin hidroklorid
- asetik asit
- sodyum acetate. 4 sulu
- sükroz
- su
Aktif içeriği
- mesajcı ribonükleik asit [mRNA-1273]
Pfizer aşısında olduğu gibi, Moderna aşısı da bağışıklık sistemini mRNA ile hazırliyor. Moderna’nın mRNA’sı da doğal olarak oluşan mRNA’dan (nükleozid modifiyeli) biraz farklıdır, bu nedenle bağışıklık sistemini yanlış noktada tetiklemez.
Lipid nanopartikül kaplaması
- SM-102
- polietilen glikol [PEG] 2000 dimyristoylgliserol [DMG]
- distearoilfosfatidilkolin (DSPC)
- kollesterol
Pfizer aşısı gibi, Moderna aşısındaki mRNA’nın da hücrelere girmesine izin vermek için yağlı bir kaplamaya ihtiyacı vardır ve bir kez daha lipidler anahtar rol oynar.
Kullanılan lipidlerden ikisi (DPSC ve kolesterol) Pfizer aşısındakilerle aynıdır. (Moderna’nın belgelerinde, DSPC, distearoilfosfatidilkolin yerine 1,2-distearoil-sn-glisero-3-fosfokolin olarak anılır, ancak aynı moleküldür, farklı, eşit derecede telaffuz edilemez bir ada sahiptir.)
Diğer iki lipid sentetik olarak tasarlanmıştır. Lipid nanoparçacık kombinasyonu yıllardır geliştiriliyor ve test ediliyor olsa da, Moderna şu anda daha küçük bir şirket olan Arbutus ile belirli lipit kombinasyonları üzerindeki patentler konusunda yasal bir savaşta. Arbutus, Moderna’nın aşı (veya diğer ürünler) üzerinden elde ettiği herhangi bir kârdan telif ücreti alıp alamayacağı belirsiz. Bu yüzden onları kimin tam olarak geliştirdiği belli değil, ancak en azından iki şirket onlara çok fazla zaman ve fon harcadı.
Tamponlar (asit-baz dengeleyicileri)
- trometamin
- tromeamin hidroklorür
- asetik asit (zayıf bir asit)
- sodyum asetat. 3 sulu
Diğer aşılarda olduğu gibi, pH’ı korumak için tamponlar kullanılır.
Trometamin ve trometamin hidroklorür kimyasal araştırmalarda çok yaygın tamponlar olsa da, muhtemelen sirkenin bir en aşina olduğunuz zayıf bir asit olan sirke asidi (asetik asit)tir. Sodyum asetat trihidrat (asetik aside çok benzer) yaygın bir gıda katkı maddesidir.
Diğer maddlere
- sükroz
- su
Diğer aşılarda olduğu gibi, bileşenleri kararlı yapmak için ve karıştırmak için şeker ve su eklenir.
Oxford-AstraZeneca
- 5 x 1010 ChAdOx1-S (rekombinant) viral partiküller (açıklama: Spike taşıyan, doz başına 50 milyar adet şempanze adenovirüsü. Adenovirüsler: çift sarmallı bir DNA genomu içeren bir ikosahedral (20 yüzlü) nükleokapsidi olan zarfsız virüsler.İlk defa insan adenoidlerinden (lenf bezleri) izole edildikleri için bu ad verilmiştir)
- L-histidin (amino asit)
- L-histidin hidroklorür monohidrat (1 sulu)
- magnezyum klorür heeksahidrat (6 sulu)
- polisorbat 80
- etanol
- sükroz
- sodyum klorür
- disodyum asetat dehidrat (2 sdulu)
- enjeksiyon için su
Aktif içeriği
- 5 x 1010 ChAdOx1-S (rekombinant) viral partiküller
Oxford-AstraZeneca aşısını ‘viral vektör’ aşı yapan ‘viral vektör’ budur. Bağışıklık sisteminizi tetikleyecek olan SARS-CoV-2 spike proteinlerini yapmak için DNA içeren nispeten uslu bir virüstür (bir adenovirüs, bir koronavirüs değil!).
Adenovirüs, çoğalamayacak veya insanlara zarar vermeyecek şekilde değiştirilmiştir. Aslen bir şempanzede bulunan bir adenovirüs üzerinde modellenmiştir, ancak bu aşının üretiminde hiçbir şempanze yer kullanılmaz. Bunun yerine, orijinal olarak bir insan böbreğinden alınan ve daha sonra genetiği değiştirilmiş hücrelerden büyütülen laboratuvar temelli hücrelerde çoğaltılır.
AstraZeneca’nın etken maddesi, adenovirüs formunda kendi kaplama paketiyle birlikte geldiğinden, Pfizer aşısı gibi lipidlere ihtiyaç duymaz. Bununla birlikte, pH’ı tamponlamak ve sabit tutmak için moleküllere ve ayrıca birkaç koruyucuya ihtiyaç vardır.
Tamponlar (asit-baz dengeleyicileri)
- L-histidin (bir amino asit çeşidi)
- L-histidin hidroklorür monohidrat
- magnezyum klorür kekzahidrat
- sodyum klorür
Pfizer aşısı gibi, pH’ı kararlı bir şekilde tutmak için tuzlar (magnezyum klorür heksahidrat ve sodyum klorür) ve aminler (L-histidin ve L-histidin hidroklorür monohidrat) eklenir.
Her iki tuz da doğal olarak oluşan minerallerdir, L-histidin ise amino asit olarak bilinen bir moleküldür. Bu bileşikler, proteinlerimizin yapıldığı şeydir, bu yüzden içinizde zaten bol miktarda L-histidin var. L-histidin hidroklorür monohidrat, histidine benzer (dolayısıyla adı) ve ayrıca gıdalarda, kozmetiklerde ve sabunlarda kullanılır.
Emulsifiye (kıvam verici) madde
- polisorbat 80 (gıda ve kozmetikte sıklıkla kullanılan iyonik olmayan bir yüzey aktif madde ve emülgatör)
Yağlı maddeler (adenovirüslerin dış kısımları gibi) ve sulu şeyler birbirine iyi karışmaz, bu nedenle AstraZeneca aşısı bunları birleştirmek için bir emülgatör gerektirir. Bir emülgatör, hem hidrofobik (yağlı) hem de hidrofilik (sulu) bölümlere sahip olan ve bunların karışmasını sağlayan bir moleküldür (deterjanlar ve sabunlar yaygın bir örnektir; yumurta sarısındaki lesitin bir başka örnektir).
Polisorbat 80, emülsifiye edici özelliklerinden dolayı yaygın bir gıda katkı maddesidir ve aynı zamanda diğer, COVID olmayan aşılarda da kullanılmıştır.
Prezarvatifler (koruyucular)
- ethanol (alkol)
- Etilendiamintetraasetik asit (EDTA)
AstraZeneca aşısı çok steril koşullarda muhafaza edilmesine rağmen, flakonlardan veya üretim sürecinden kaynaklanan her türlü kontaminasyonu önlemek için koruyucular kullanır. (Pfizer koruyuculardan kaçınmayı tercih etti, bu da aşının daha az içerik gerektirdiği anlamına gelir, ancak kontamine olmadıkları garanti edilemediğinden bazı dozlar atılmıştır.)
Koruyucu olmasının yanı sıra, etilendiamintetraasetik asit (EDTA), bazı metal zehirlenmelerinin tedavisi için onaylanmış bir ilaçtır. Etanol, el dezenfektanı, bira ve şarapta elde ettiğiniz alkolle aynıdır, ancak 0.5 milimetrelik bir dozda %0.005’ten daha düşük bir konsantrasyonda kandaki alkol içeriğinizi etkilemez.
Diğer içerikler
- sükroz
- su
Pfizer aşısında olduğu gibi, bileşenleri kararlı kılmak için şeker ve tüm bileşenleri birleştirmek için su kullanılır.
Kaynak: Cosmos Dergisi (Avusturalya)