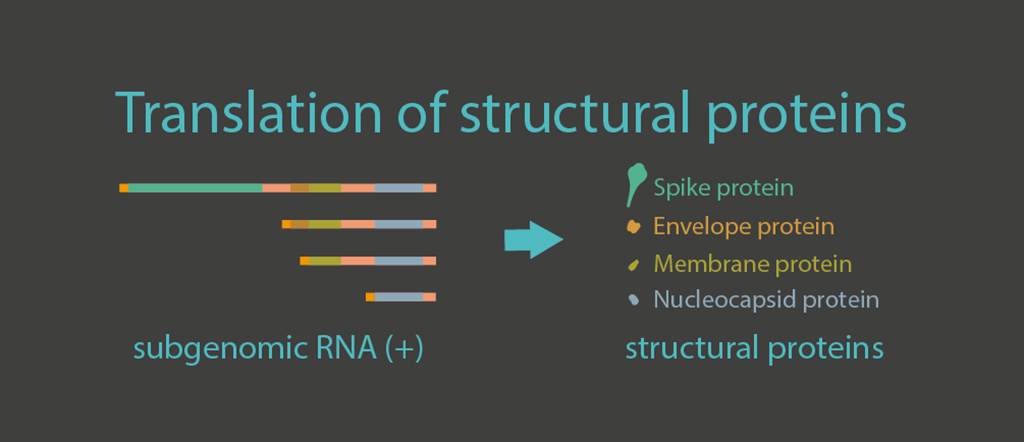
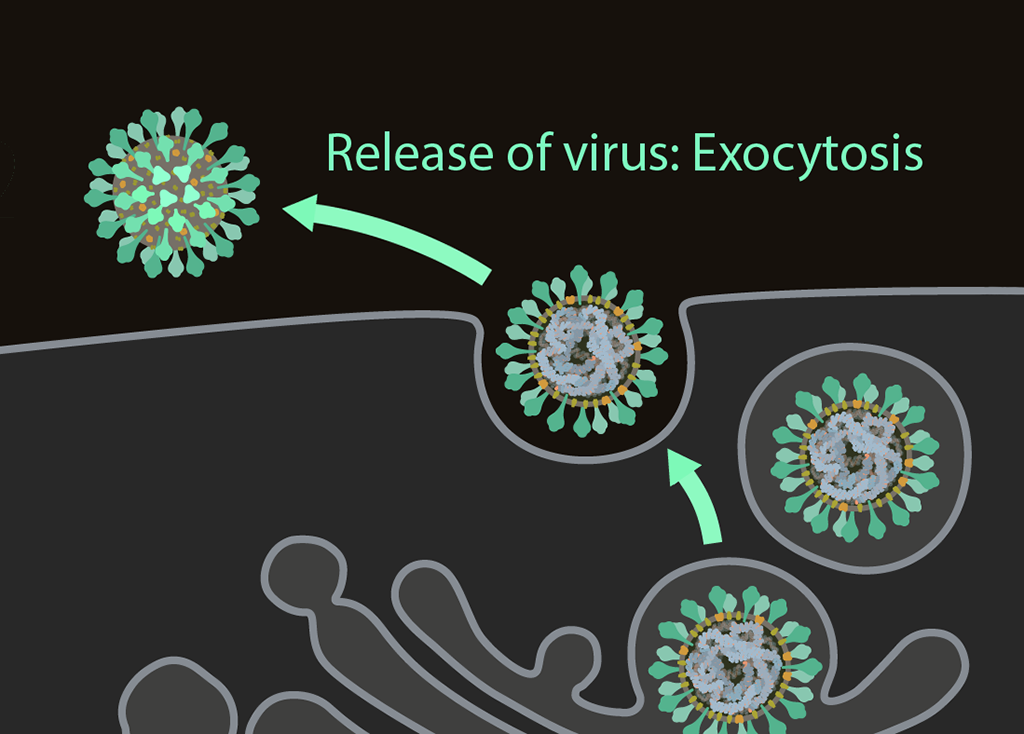
Virüslerin küçük ve gizemli dünyasını keşfetmek
Yazı: LAUREN E. OAKES BRYCE, Çizim: GLADFELTER 17 NISAN 2021, NAITULUS
Şekil olarak hafifçe oval ve kenarları biraz bulanık olan siyah lekeler, postmodern bir tabloya çok benzeyen, benekli gri bir arka plana dağılmıştı. 1938’de Berlin Tıp Derneği’nin bir toplantısında, Alman bir doktor ve biyolog olan Helmut Ruska, virüs parçacıklarının şimdiye kadar görülen ilk görüntülerini sunuyordu. Lekeler, poksvirüs ailesinin üyeleriydi, özellikle ektromelia, doğrudan enfekte farelerin lenf sıvılarında görselleştirildi.
O zamanlar Übermikroscop olarak bilinen elektron mikroskobunun icadı sayesinde , bilim adamları nihayet zaten var olduğu bilinen şeyi gözlemleyebildiler, yani aslında görebildiler: virüslerin küçük ve gizemli dünyası. Ruska’nın bir fizikçi olan kardeşi Ernst, doktorasını tamamlarken enstrümanın ilk prototipini yapmıştı, ancak Helmut cihazın biyoloji alanındaki potansiyel uygulamasını gördü. Helmut ve meslektaşları 1939’un sonunda virüslere ait yaklaşık 2.000 siyah beyaz resim toplamışlardı. Koleksiyonlarında, çiçek hastalığına neden olan variola virüsü ve tütün mozaik virüsü (keşfedilen ilk virüs) de vardı.
Yapısı basit ancak işlevselliği gelişmiş olan virüsler, “cansız ve canlı arasında” yer alan bir kategoride bulunur.
Bilim insanları, 80 yıldan biraz daha uzun bir süre sonra, COVID-19’a neden olan yeni virüs olan SARS-CoV-2’nin ilk görüntülerini yayınladı. İkonik başak (taç) proteinini ortaya çıkarmak için Ruska’nınkine benzer bir alet kullandılar. Siyah beyaz görüntüler, bunun koronavirüs ailesinin bir üyesi olduğunu görsel olarak doğruladı ve dünyanın dört bir yanındaki bilim insanlarının bu tür virüsler hakkında yıllarca önceki araştırmalarından elde edilen mevcut bilgilerden yararlanmaya başlanmasını sağladı. Bilim insanları, bu yeni virüsü, Çin’deki bir grup hastaya Aralık 2019’un sonlarında nedeni bilinmeyen bir pnömoni teşhisi konduktan hemen sonra doğrudan gözlemleyebildiler. Mart 2020’ye gelindiğinde COVID-19, Dünya Sağlık Örgütü tarafından bir salgın ilan edilmişti.
Önceki salgınlarda olaylar çok daha yavaş ilerliyordu. 1300’lerin ortalarında meydana gelen Kara Ölüm (vaba) salgını, dört yıl içinde Avrupa nüfusunun üçte birinden fazlasını, kimse buna neyin sebep olduğunu bilmeden öldürdü. 1918 grip salgınında, bilim adamları hastalığın nedeninin biliyordu ancak bunun için virüs görecek araçlar veya onu test edecek PCR gibi testler yoktu. SARS-CoV-2 ortaya çıktığında, onlarca yıl önce yürütülen temel bilim araştırmalarının değeri, virüs tespiti için yenilikçi araçlar biçiminde hızla ortaya çıktı. Araştırmacılar artık yeni virüslerin genomlarını dizileyebilie ve genomlarını inceleyebiliyordu. Ancak bugün bile gelişmiş genomik teknolajilere rağmen bile elektron mikroskobu bu tür patojenlerin benzersiz bir “açık” görünümünü sunmaya devam ediyor.
ABD Hastalık Kontrol Merkezleri (CDC) için patojenleri belirlemek için elektron mikroskobu kullanan Cynthia Goldsmith, “Bir resimle gerçekten tartışamazsınız” diyor. “Bu teknoloji, yalnızca virüsün nasıl göründüğünü değil, aynı zamanda hücrede nasıl büyüdüğünü de görmemizi sağlıyor.” Goldsmith yıllar içinde sayısını tahmin bile edemeyeceği kadar çok virüs tespit etmiş olsa da, incelediği virüsler zaten hastalığa neden olduğu bilinenlerle ve esas olarak insanları enfekte edenlerle sınırlı. Ancak bilim adamları , memeli ve kuş ev sahiplerinde 1.67 milyon henüz keşfedilmemiş viral türün var olduğunu tahmin ediyor . Örneğin yarasalar, yeni koronavirüs türleriyle doludur . Evrendeki yıldızlardan daha fazla virüs olabilir . Bugün yürütülen temel bilim araştırmaları, onların geçmişini, bugününü ve geleceğini anlamamıza ve bizi daha da yeni virüslerin ortaya çıkmasına daha iyi hazırlamamıza yardım etmede kritik bir rol oynayacaktır.
Stanford Üniversitesi’nden Laura Bloomfield, “Bilim adamları ve halk sağlığı yetkilileri, bir sonraki salgının ne zaman ve nerede ortaya çıkacağını düşünmek için çok zaman harcadılar” diyor. “Ama öğrendiğimiz şey, bunu kesin olarak tahmin etme olasılığının çok düşük olduğu. Hazırlık ve müdahale etmek için yapıları yerli yerince yerlerine koymamız ve aynı zamanda gelecekteki salgınları en başta önlememiz gerekiyor. ”
Bu, temel bilim araştırmalarına girmek anlamına gelecektir. Bu, yalnızca daha fazla virüs keşfetmek ve dizilemek anlamına gelmeyecek, aynı zamanda virüslerin yapılarını anlama yeteneğimizi, konakçılarıyla nasıl etkileşime girdiklerini ve tarih boyunca nasıl evrimleştiklerini daha iyi hale getirecek araştırmalara yatırım yapmak anlamına gelecektir. Ek olarak, bir sonraki salgına hazırlanmak aynı zamanda insan davranışına daha fazla odaklanmak ve doğa ile olan ilişkimizi onarmak anlamına gelecektir. Yerel ormanların, endüstriyel ormancılık veya tarım için tahrip edilmesi, insan yerleşimlerinin veya arazi kullanımının el değmemiş ve bozulmamış ekosistemlere genişletilmesi ve vahşi yaşamın ticareti gibi faaliyetler, başka bir felaket salgını olasılığını büyük ölçüde artırır.
Virüslerin keşfi
Ruska’nın zamanında araştırmacılar, virüsleri belirleyip tanımlamak için “filtrelenebilir bulaşıcı ajanlar” terimini kullandılar. Deney, çıplak gözle görülemeyen bu küçük varlıkların, bakterileri ve diğer mikroorganizmaları yakalayan ve tutan filtrelerden geçebildiğini ortaya çıkardı. Latince bir kelime olan “yapışkan sıvı“, “güçlü meyve suyu” veya “zehir” anlamına gelen “virüs” terimi, hem filtrelerden geçebilecek kadar küçük hem de canlı bir konakçı olan bitkinin veya hayvanın yardımı olmadan üreyemeyen ajanlar için kullanılmıştır. Hollandalı bir mikrobiyolog ve botanikçi olan Martinus Beijerinck, 19. yüzyılda hastalıklı tütün bitkisi yapraklarından elde edilen öz (ekstrakt) ile deneyler yaparak virüslerin hastalığa neden olduğunu gösterdi.
Beijerinck, ışık mikroskobu ile tespit edilemeyecek kadar küçük bir varlığın bitkileri enfekte edebildiğini gösteren ilk bilim insanlarından biriydi. Beijerinck’in hasta bitkilerden taze ekstrakte edilmiş özsu uygulaması, sağlıklı bitkilerin yapraklarında lekeler oluşturdu; ne kadar çok özsuyu uygularsa, semptomlar o kadar kötüydü. Hasta bitkilerden elde edilen özsuyu contagium vivum Fluidum (bulaşıcı canlı sıvı) olarak adlandırdı. Bunun, “bölünen ve büyüyen hücrelerin içine girdiğini”, yani çoğalmak için başka canlıların (bu durumda bitki hücrelerinin) gerekli olduğu anlamına geldiğini belirtti.
Beijerinck’in diğer bitkileri enfekte edebilen bu “sıvı zehri” keşfetmesi, bugün yeni virüsleri belirleme, tanımlama, morfolojilerini (yapılarını) deşifre etme ve bu bilgileri, virüslerin neden oldukları hastalıklara karşı tedaviler geliştirmek için kullanma yeteneğimizin temelini oluşturdu. Ama aynı zamanda popüler virüs algımızı sadece patojenik, yani hastalığa neden olabilecek şekilde önyargılı hale getirdi. Çoğu durumda, virüsler hastalığa neden olmaz ve hatta birçoğu yararlıdır. Bazı virüsler sağlık için tehdit oluştururken, diğerleri yararlı işlevler yerine getirerek hayatımızı daha iyi ya da daha kötü şekilde şekillendirirler.

Virüsler hayatı nasıl şekillendirir?
Yapısı basit, ancak işlevselliği gelişmiş olan virüsler, “cansız ve canlılar arasında yer alan” bir kategoride bulunur. Bazı biyologlar onları yarı canlı olarak düşünürken, diğerleri onlardan cansız küçük parçacıklar (partiküller) veya madde düzenlemeleri (montajı) olarak bahsediyor. Ancak uzmanlar, bunların hayat ağacını saran sarmaşıklar gibi oldukları konusunda hemfikir; Varoluşları, iki yaşam biçimi arasında yakın bir ilişki olan simbiyozu içerir. Virüsler yalnızca canlı hücrelerin içinde çoğalabilir. En sağlıklı halimizde bile, vücudumuz trilyonlarca virüse, belki daha fazlasına ev sahipliği yapar. Orada “canlı” gibidirler. Çünkü genetik materyalleri konakçılarının hücrelerine nüfuz edip onları virüs üreten fabrikalara dönüştürür.
Wildlife Conservation Society’nin Sağlık Programı’ndan hastalık ekolojisti Sarah Olson, “Bir virüs ve bir hücreyi birlikte mikroskobik bir kopya makinesi olarak düşünün” diyor. “Virüs, hücreye girmek için mevcut giriş noktalarını kullanıyor – ve girdiğinde, hücrenin mekanizmasını ele geçirmek ve kendisinin kopyalarını yapmak için talimatlar taşıyor. Sonra bir sonraki makineye (hücreye) gider. “
“Viruslar”, hücrelerin çok eski zamanlardan gelen torunları olabilir, ancak bazı araştırmacılar onların yaşamın dördüncü bir boyutunu oluşturabileceklerini öne sürüyor.
Bir virüs, bir dizi adımda çoğalır: önce bir konakçı hücreye bağlanır ve kendi genetik materyalini (DNA veya RNA) enjekte eder, ardından hücre daha fazla virüs ürettikçe kendisini hücrenin genetik materyaline dahil eder. Viral bilgi bir konakçının genomuna entegre edildiğinde, bu bilgi konağın bir parçası haline gelir ve nesiller boyunca aktarılabilir. Aslında, insan genomunun yaklaşık yüzde 8’i viral genlerden geliyor, bu da virüslerle birlikte evrimleştiğimiz ve bunu yapmaya devam edeceğimiz anlamına geliyor. Ayrıca, virüsler olmadan, insanlar ve diğer memeliler “doğurma” yerine hala “yumurta bırakıyor” olabilirdi. Evrim sırasında bir noktada, plasenta oluşumu için gerekli olan protein sintin, bir retrovirüs enfeksiyonundan geldi. Ayrıca virüslerin, bakterilerin bağırsaklarımızı işgal etmesini önleyebileceğini de biliyoruz.
Diğer canlılar gibi virüsler de Darwinci bir misyonu yerine getiriyorlar: sayılarını olabildiğince artırmayı, coğrafi sınırlarını genişletmeyi ve zaman içinde hayatta kalmayı hedefliyorlar. Aşılar piyasaya sürülürken ve yeni varyantlar tanımlanırken bile, SARS-CoV-2’nin şu anda yaptığı tam olarak budur. Ancak geçmiş hala önemlidir. Seattle’daki Fred Hutchinson Kanser Araştırma Merkezi’nde biyolog olan Michael Emerman’ın söylediği gibi, virüslerin evrimsel tarihindeki eski olayları incelemenin motivasyonu, acil modern zorlukları daha iyi anlamaktır.
Virüslerin kökenleri ve tarihsel geçmişleri neden önemli
Virüslerin kökenleri ve evrimleri üzerine yapılan temel araştırmalardan ortaya çıkan modeller, gelecekteki pandemilere hazırlıklı olma durumumuzu bilgilendirmeye yardımcı olabilir. Viral evrim hakkında yazılar yazan biyolog Julia Durzyńska (Polonya, Poznań’daki Adam Mickiewicz Üniversitesi), “Mevcut tüm virüslerin kökenleri hakkında tek bir açıklamaya sahip olmak istersiniz” diyor. “Bunun yerine, birbirini tamamlayan üç baskın model var.”
Sözde “virüsler ilktir” modeli, yaşamın başlangıcında, hücrelerden önce çok basit virüs formlarının var olduğunu öne sürüyor. Modern virüslerin eski ataları, hücresel yaşamın gelişimi için hammadde sağlamış olabilir. Bu model bugün dünyadaki tüm virüsler için geçerli olsaydı, hepsinin birkaç viral atadan evrimleştiği anlamına gelirdi. Bazı açılardan bu, yeni virüslerin tanımlanmasını ve aşıların veya tedavilerin geliştirilmesini kolaylaştırırdı: bilim adamları, bir virüs hakkında bildiklerini alıp, akrabalarını anlamak için bunu başlangıç noktası olarak kullanabilirdi.
Viral kökenlerin ikinci model “kaçış” veya “ilerleyen modeli“, virüslerin daha büyük organizmaların genlerinden kaçan genetik unsurlardan kaynaklandığını öne sürer. Örneğin bakteriyofajlar (bakterileri enfekte eden virüsler), bakteriyel genetik materyal parçalarından gelir. Dolayısıyla bu modele göre, tüm virüsler çok hücreli yaşamın varolmasından önce, çok eski zamanlardan gelmiyor.
“İndirgeme” modeli olarak bilinen üçüncü model, virüslerin bir zamanlar daha büyük, serbest yaşayan organizmalar olduğu hipotezine dayanmaktadır. Zamanla genetik bilgilerini kaybettiklerine ve sonunda küçüldüklerine ve tek başına üreyemediklerine inanılıyor. Ancak diğer organizmaların hücrelerinde çoğalarak varlıklarını sürdürmeyi başardılar. Bu modelin en yaygın şekilde kanıtı olarak yorumlanan keşif, ilk olarak 2003 yılında izole edilen ilk “dev virüs” olan mimivirüstür.
Dev virüsler viral dünyaya bakışımızı nasıl genişletti?
Yirmi beş yıl önce, şu anda Davidson Koleji’nde biyolog olan David Wessner, koronavirüsler üzerine çalışan bir araştırma ekibinde doktora sonrası bir akademisyendi. Çalışması, virüslerin dışından çıkıntı yapan sivri uçlu (taç, Spike) proteinleri incelemeyi ve hücrelerle nasıl etkileşime girdiklerini belirlemeyi içeriyordu. Wessner, “Bu temel araştırmaların çoğu, COVID-19 ortaya çıktığında tepki vermeye zemin hazırladı,” diyor ve aynı şey dev virüsler üzerine yapılan temel araştırmalar için de geçerli olabilir. Henüz insan sağlığını önemli ölçüde etkileyen dev bir virüs tanımlamadık, ancak bu değişebilir. “
Daha sonra mimivirüs olarak adlandırılacak olan şey ilk olarak İngiltere’de 1992 pnömoni salgınının araştırılması sırasında gözlemlendi. Fransa’daki Aix-Marseille Université’de bir mikrobiyolog olan Bernard La Scola, bilinmeyen varlığı izole etmek ve yapısını incelemek için çok yıllık bir çabaya öncülük etti. O sırada elektron mikroskobu ile çalışan bir arkadaşı vardı. La Scola, “Ona bir örnek verdim” diyor. “Ona bu ilginç konuya bakıp bakamayacağını sordum ve ne olduğu hakkında hiçbir fikrim olmadığını söyledim.”
La Scola, ortaya çıkan görüntüyü ilk gördüğünde dev bir virüsü düşünmediğini söylüyor.
“Ölçeğe baktıktan sonra virüs olamayacak kadar büyük olduğunu fark ettim. Ve biz de bununla çalışmaya başladık. ” La Scola ve meslektaşları, yeni bir şeyi izole ettiklerini biliyorlardı.
Virüsler, sayılarını olabildiğince artırmayı, coğrafi sınırlarını genişletmeyi ve zaman içinde hayatta kalmayı hedefler.
Nihayetinde, mimivirüsün ( Acanthamoeba polyphaga ) ve daha sonra mamavirüsün ve daha sonra daha da büyük pandoravirüsün keşfi, göreceli boyutları ve genetik karmaşıklıkları göz önüne alındığında, bir virüs olmanın ne anlama geldiğine dair insan algısını değiştirdi. Bazı bilim insanları, “bunların” derin eski zamanlardan gelen hücrelerin torunları olabileceğini düşünürken, diğerleri, yaşam ağacı modelini oluşturan arkeler, bakteriler ve ökaryot domeynlerinden farklı olarak, yaşamın dördüncü bir boyutunu oluşturabileceklerini öne sürüyorlar.
La Scola, virüslerin kökeni ile ilgili tartışmalara pek girmez; bunun yerine yeni virüsleri izole etmeye ve tanımlamaya odaklanır. Yıllar boyunca, kendisi ve öğrencileri, üniversitesi, Méditerranée Enfeksiyon Vakfı ve Fransa Sağlık Bakanlığı dahil olmak üzere çeşitli kaynaklardan fon aldılar, ancak La Scola, dev virüsler üzerindeki çalışmalarının çoğunun fonlanmadığını söylüyor. Diğer, daha uygulamalı projeler için aldığı fondan ve kendisinin ve diğerlerinin yoğun ilgisinden ve ısrarından yararlandı.
Bugün, dev virüslerin insan sağlığını dramatik bir şekilde etkilediği bilinmese de, La Scola temkinli bir şekilde Afrika domuz ateşi virüsü Asfivirus’a işaret ediyor. Kenelerden domuzlara ve domuzlar arasında geçiş yapar. Kanamalı ateşe neden olur ve La Scola ve ekibinin Marsilya’da kanalizasyondan izole ettiği dev bir virüsle yakından ilgilidir.
“Bu bir genom indirgeme örneği, çünkü genomunun yaklaşık üçte ikisini kaybetti” diyor. “Ve şimdi bu dev virüs muhtemelen omurgalılarda, yani domuzlarda hemorajik ateşin etkeni.” Virüs daha büyük bir organizmadan gelmiş ve hastalığa neden olacak şekilde evrimleşmiş olabilir. Bir kez oldu, bu yüzden tekrar olabilir ve belki de insanlarda.
2020’de La Scola ve meslektaşları, başka bir yeni virüs olan Yaravirüs‘ün şaşırtıcı kökenleri üzerine bir makale yayınladılar. Virüsü genetik bilgisini deşifre etmek için dizilediklerinde, bazı genlerin dev virüslerde bulunanlara benzer göründüğünü fark ettiler, ancak Yaravirüs’ün onlarla nasıl ilişkili olup olmadığını çözemediler. Genlerinden hiçbiri, bilinen organizmaların herhangi bir dizisiyle eşleşmedi. Tamamen yeniydi. Yani benzersiz genetik bilgilerle karakterize edilen bir karanlık madde virüsü idi. Böylesine karanlık bir madde, uçsuz bucaksız bir uçurum, daha iyi anlamamız gereken viral bir dünyanın kanıtıdır.
İnsan davranışının rolü
Sağlıklı ormanlar gibi bozulmamış ekosistemlerde, virüsler ve vahşi konakçıları uzun zamandır birbirleriyle hassas bir denge içinde etkileşime girmişlerdir. İnsanlar bilim insanlarının”mevcut hastalık ekolojisi ağı” dedikleri şeye müdahale ettiklerinde, kendilerini genellikle yabancı virüslere maruz bırakırlar. Benzer şekilde, vahşi hayvanları ormandan alıp ticari pazarlara taşımak da insanları yeni virüslere maruz bırakır. İleriye bakıldığında, insanların viral dünyayla gezinmeleri kısmen “uçta”, yani insanların ve vahşi yaşamın etkileşime girdiği ve patojenlerin değiş-tokuş edildiği bozulmuş habitatlar tarafından şekillendirilecektir.
Bloomfield, “Bununla ilgili bir ölçü var: kenar yoğunluğu” diyor. Kenar yoğunluğu, insanların günlük faaliyetlerini gerçekleştirdiği bir arazideki parçalanmanın şeklini ve kapsamını ifade eder. Ağaç kesmek, yollar inşa etmek ve kentsel yerleşimlerin genişletilmesi bu tür parçalanmaya neden olabilecek faaliyetlerdir.
Çevresel bozulma, insanlar ve hayvan habitatları arasında daha fazla “kenar” ve dolayısıyla insanların daha önce maruz kalmadıkları virüslerle daha fazla temas etme olasılıkları yaratır. Bloomfield, peyzajları değiştirmenin insanlar ve vahşi yaşam arasındaki etkileşimi nasıl teşvik ettiğini ve bulaşıcı hastalıkların ortaya çıkışını nasıl etkilediğini araştırıyor. Bulaşıcı hastalık uzmanları genellikle belirli hastalıklara odaklanırken, halk sağlığı uzmanları genellikle virüsün yarasa veya maymundan insana geçişi (zoonotik) gibi bir türden diğerine geçtiği yayılma olaylarının ayrıntılarını araştırır. Ancak Bloomfield, çok daha büyük modellerle ilgileniyor: insan davranışının çevresel bozulmayı nasıl yönlendirdiği, sınır yoğunluğunu ve dolayısıyla hastalık bulaşma riskini nasıl artırdığı.
Amazon ormanına açılan yolların balık kılçığı deseni yaygın bir örnektir. 2000 ve 2001’de Peru’daki araştırmacılar, ormansız bölgelerde sivrisinekler tarafından nispeten bozulmamış alanlara kıyasla 278 kat daha yüksek ısırma oranını belgelediler. Yeni güneşli havuzlarda sivrisinekler hızla çoğaldıkça ve insanlar ormana girdikçe sıtma vakaları arttı. Uganda’da Bloomfield’ın araştırması, hane halkları ve ev yapımı için malzeme toplama gibi faaliyetler etrafında daha fazla kenar yoğunluğu olduğunu ortaya koydu. Ormanlık habitatlarda yiyecek arama, insanlarla diğer primatlar arasındaki temas olasılığını da artırır. Araştırmacılar, orman bozulmasının Nipah, Hendra ve Ebola gibi vahşi yaşamdan kaynaklanan birçok virüsün salgınlarıyla ilişkili olduğunu bulmuşlardır.
Bloomfield, “Biyolojik çeşitliliğin daha yüksek olduğu alanlar ve bu biyolojik çeşitliliğe insan müdahalesi kesinlikle endişe verici konulardır” diyor. “Türler arasında ne kadar çok etkileşim olursa, nadir bulaşma olayları için o kadar yüksek olasılık var” diye belirtiyor. Yeni hastalıkların ortaya çıkışıyla ilgili ileri görüşlü bir kitap yazan bilim muhabiri David Quammen, fenomenin bir çift zar atma ve yılan gözü alma şansına benzediğini açıklıyor. Bir zar atma olasılıkları düşüktür, ancak zarları yeterince sık atarsanız, sonunda bir çift ile sonuçlanırsınız. Doğru virüs insanlara doğru koşullar altında bulaştığında yayılmalar ve salgınlar meydana gelebilir. Modern seyahat ve dünya genelindeki mevcut insan bağlantı düzeyimiz, enfekte bir kişi bir yerden diğerine seyahat ettiğinde bir salgının hızla salgın haline gelebileceği anlamına geliyor.
Belki de doğru dengeyi ancak viral dünyayı ve virüslerin hayatlarımızı şekillendirmeye devam ettiği birçok yolu daha iyi anlayarak, bize saldırıp, bir parçamız haline gelerek ve bize yardım ederek bulabiliriz. Bozulmayı ve vahşi yaşam ticaretini durdurmak, insanları yeni ve potansiyel olarak zararlı virüslerden ayrı tutmamıza da yardımcı olacaktır.
2015’ten önce, ortaya çıkan bulaşıcı hastalıklarla ilgili veriler, ihmal edilen hastalıklarla ilgili araştırma ve geliştirme için küresel finansmanı izleyen ve raporlayan bir proje olan G-FINDER tarafından takip edilmiyordu (küresel düşünce kuruluşu Policy Cures Research’ün himayesinde ve Bill ve Melinda Gates Vakfı). Ebola salgınının bir kombinasyonu; SARS, MERS ve H1N1 gibi pandemiler; ve küresel sağlık güvenliğine ilişkin artan endişe, sorunu SARS-CoV-2’nin ortaya çıkmasından önce bile kolektif bilinçte gündeme getirdi. Yine de, virüsler ve ortaya çıkan bulaşıcı hastalıklarla ilgili temel bilim araştırmalarına yönelik finansman, birçok uzmanın olması gerektiğini düşündüğü yerde değil.
İnsanlar, hayvanlar, bitkiler ve onların paylaşılan çevreleri arasındaki karşılıklı bağlantıların giderek daha fazla tanınması (ve bu bağlantıların insan sağlığı üzerindeki etkileri) daha disiplinler arası araştırma ve işbirliğine doğru bir paradigma değişimini de gerektirecektir. İnsanların, hayvanların ve çevrenin sağlığı derinlemesine iç içe olduğu için, araştırma çabaları ve problem çözme tıp ve çevre bilimcilerinin çabaları arasında köprüler kurulmasını gerektirir. Şimdiye kadar, bu tür disiplinler arası araştırmayı teşvik eden pek çok mekanizma yok. Bloomfield, “Bence vakıflar muhtemelen bu desteğin çoğunu bulacağımız yer” diyor.
Dünyanın dört bir yanındaki bilim insanları, yeni koronavirüsün ilk görüntülerinin elde edilmesinden bir yıldan kısa bir süre sonra COVID-19’a karşı etkili bir aşı geliştirerek bu yıl tarih yazdı. Böylesine benzeri görülmemiş bir tepkinin temelini oluşturan temel bilim araştırmasıydı; geçmişte aşıların geliştirilmesi genellikle 10 ila 15 yıl sürmüştür. Kısmen doğayla ve birbirimizle devam eden etkileşimlerimizle şekillenen geleceğimiz, bu yaklaşımın sürdürülmesini gerektiriyor: mevcut bilgiyi eyleme geçirmek ve hala tam olarak bilmediğimiz viral bir dünyayı deşifre etmeyi amaçlayan temel araştırmaları desteklemek.
Lauren E. Oakes, Yaban Hayatı Koruma Derneği’nde koruma bilimcisi, Stanford Üniversitesi Yer Sistemi Bilimi Bölümü’nde yardımcı profesör ve bilim yazarıdır. Kanarya Ağacı Arayışında (Temel Kitaplar, 2018) yazarıdır .
Bu makale ilk olarak Science Philosophy Alliance Channel’da Nisan 2021’de yayınlandı.