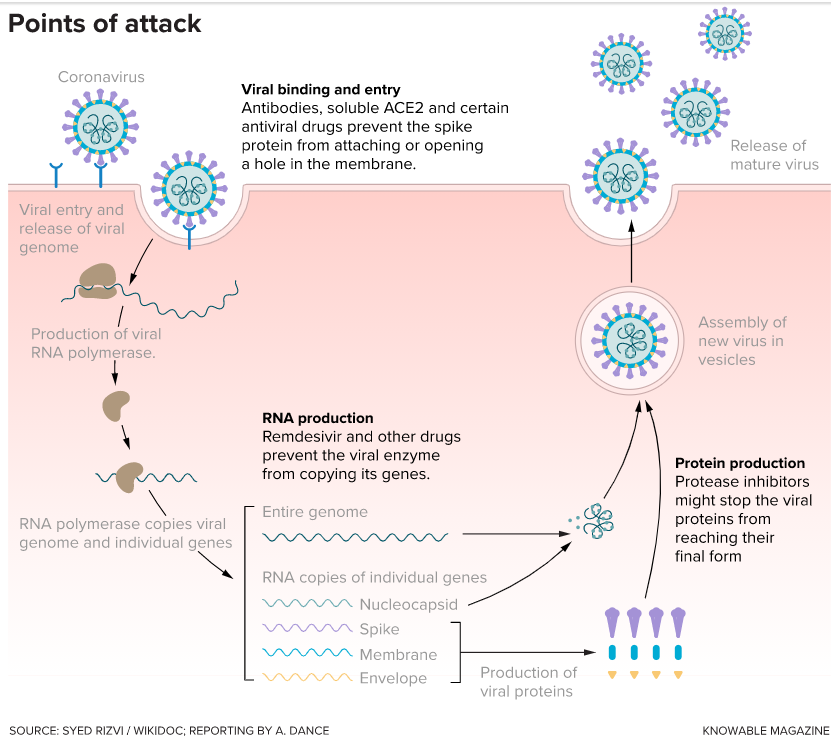
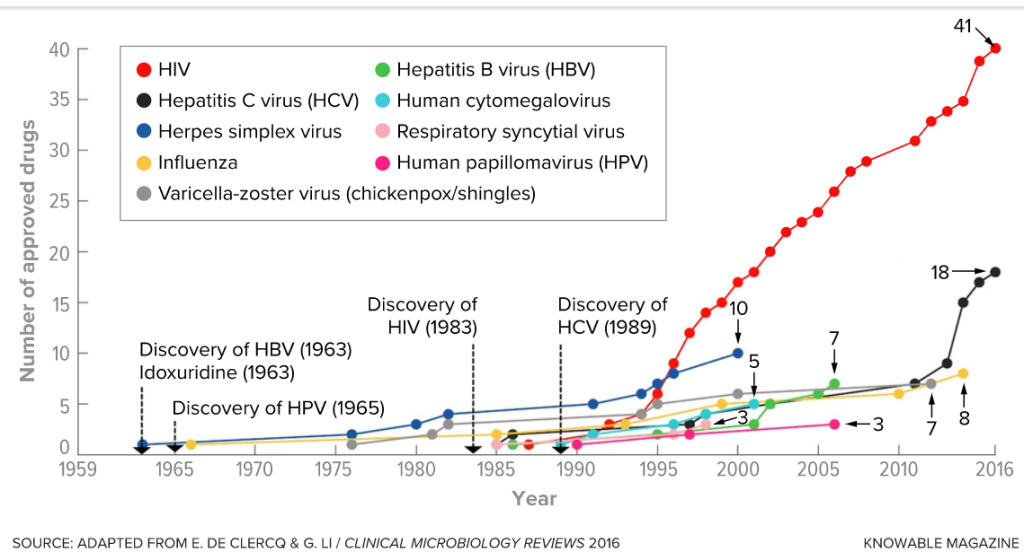
İnsan genetik alfabesinin (İnsan Genom Haritası) dizisinin belirlenmesinin 15. yaş gününü 5 yıl önce burada yazmıştım…

2020 Haziran, 20 yaş günü oldu…
Verilerin paylaşılması hayat kurtarabilir. Halka açık verilerin ifşası için “Bermuda Prensipleri”, İnsan Genom Projesi (HGP) sırasında ilk insan referans DNA sekansını üretmenin temel mirasıdır. 1990’lardan beri bu ilkeler, açık bilim için bir mihenk taşı haline geldi.

İnsan Genom Projesi nedir?
İnsan Genom Projesi (HGP), hedefi insanoğlunun tüm genlerinin tam olarak haritalanması ve anlaşılması olan uluslararası, ortak bir araştırma programıdır. Tüm genlerimiz birlikte “genomumuz” olarak bilinir.
Hedefler
İnsan Genomu Projesi’nin ana hedefleri ilk olarak 1988’de ABD Ulusal Bilimler Akademisi’nin (NAS) özel bir komitesi tarafından ifade edildi ve daha sonra Ulusal Sağlık Enstitüleri (NIH) ve Enerji Bakanlığı (DOE) tarafından ortaklaşa yazılan ayrıntılı bir dizi beş yıllık planla kabul edildi. Kongre, bu kavramın daha fazla araştırılmasına girişmek için hem NIH hem de DOE’yi finanse etti ve iki hükümet kurumu, “insan genomu ile ilgili araştırma ve teknik faaliyetleri koordine etmek” için bir Mutabakat Zaptı imzalayarak bir anlaşma resmileştirdi. James Watson, İnsan Genomu Araştırma Ofisi olarak adlandırılan NIH bileşeninin başına getirildi. Ertesi yıl, İnsan Genomu Araştırma Ofisi, Ulusal İnsan Genomu Araştırma Merkezi’ne dönüştü. 1990 yılında, “Genetik Mirasımızı Anlamak: İnsan Genomu Projesi, İlk Beş Yıl, 1991-1995 MY” ortak araştırma planının yayınlanmasıyla ilk planlama aşaması tamamlandı. Bu ilk araştırma planı, daha sonra 15 yıllık bir araştırma çalışması olacağı öngörülen ilk beş yıl için özel hedefler ortaya koydu. HGP araştırmacıları insan genomunu üç ana yoldan deşifre ettiler: genomumuzun DNA’sındaki tüm bazların sırasını veya “dizisini” belirlemek; tüm kromozomlarımızın ana bölümleri için genlerin konumlarını gösteren haritalar yapmak; ve kalıtsal özelliklerin (genetik hastalıklar gibi) nesiller boyunca izlenebildiği bağlantı haritaları olarak adlandırılan şeyleri üretmek.
Etkisi
HGP, muhtemelen yaklaşık 20.500 insan geni olduğunu ortaya çıkardı. HGP’nin bu nihai ürünü, dünyaya insan genlerinin tamamının yapısı, organizasyonu ve işlevi hakkında ayrıntılı bilgi kaynağı sağlamıştır. Bu bilgi, bir insanın gelişimi ve işlevi için temel kalıtsal “talimatlar” kümesi olarak düşünülebilir. Uluslararası İnsan Genomu Dizileme Konsorsiyumu, insan genomunun ilk taslağını Şubat 2001’de Nature dergisinde yayınladı ve tüm genomun üç milyar baz çiftinin yaklaşık yüzde 90’ı tamamlandı. Konsorsiyuma katılan 2.800’den fazla araştırmacı yazarlığı paylaştı. Bu ilk taslağın şaşırtıcı bir bulgusu, insan genlerinin sayısının önceki tahminlerden önemli ölçüde daha az olmasıydı, bu sayı 50.000’den 140.000’e kadar değişiyordu. Tam dizi tamamlandı ve Nisan 2003’te yayınlandı. Şubat 2001’de genomun çoğunluğunun yayınlanması üzerine, o zamanlar Ulusal İnsan Genomu Araştırma Enstitüsü müdürü olan Francis Collins, genomun çoklu kullanımları olan bir kitap olarak düşünülebileceğini belirtti: “Bu bir tarih kitabı – bir anlatı türümüzün zaman içindeki yolculuğunun bir parçası. Bu, her insan hücresini inşa etmek için inanılmaz derecede ayrıntılı bir plan içeren bir mağaza kılavuzu ve sağlık hizmeti sağlayıcılarına tedavi etmek, önlemek ve iyileştirmek için muazzam yeni güçler verecek içgörüler içeren dönüştürücü bir tıp ders kitabıdır. hastalık.” HGP aracılığıyla oluşturulan araçlar ayrıca, fareler, meyve sinekleri ve yassı solucanlar gibi biyolojik araştırmalarda yaygın olarak kullanılan diğer birkaç organizmanın tüm genomlarını karakterize etme çabalarına bilgi vermeye devam ediyor. Bu çabalar birbirini destekler çünkü çoğu organizma, benzer işlevlere sahip birçok benzer veya “homolog” gene sahiptir. Bu nedenle, bir model organizmadaki bir genin dizisinin veya fonksiyonunun tanımlanması, örneğin yuvarlak kurtçuk C. elegans, insanlarda veya diğer model organizmalardan birinde bir homolog geni açıklama potansiyeline sahiptir. Elbette, bilgi yalnızca onu kullanma yeteneği kadar iyidir. Bu nedenle, araştırma sonuçlarının insanlığın yararına en hızlı şekilde uygulanmasını sağlamak için HGP’nin ürettiği bilgilerin bilim adamlarına, hekimlere ve diğerlerine geniş çapta yayılmasına yönelik gelişmiş yöntemler gereklidir. Biyomedikal teknoloji ve araştırma, HGP’nin özel faydalanıcılarıdır. Bununla birlikte, HGP’nin mümkün kıldığı ayrıntılı genetik bilgiye sahip olmanın bireyler ve toplum için önemli çıkarımları en baştan kabul edildi. HGP’nin diğer bir önemli bileşeni – ve NHGRI’nin süregelen bir bileşeni – bu nedenle, yeni keşfedilen bilgilerimizin etik, yasal ve sosyal sonuçlarının (ELSI) analizine ve daha sonra kamuoyu değerlendirmesi için politika seçeneklerinin geliştirilmesine ayrılmıştır.
Sonuçlar
2003 yılında, doğru ve eksiksiz bir insan genom dizisi tamamlandı ve orijinal İnsan Genom Projesi programından iki yıl önce ve orijinal tahmini bütçeden daha düşük bir maliyetle bilim adamları ve araştırmacıların kullanımına sunuldu.
İnsan genomundaki 3 milyar DNA harfini sıralamayı amaçlayan bu uluslararası çaba, birçokları tarafından atomu bölmek veya aya gitmeye kıyasla tüm zamanların en iddialı bilimsel girişimlerinden biri olarak görülüyor. İnsan Genom Projesi tarafından üretilen bitmiş dizi, insan genomunun gen içeren bölgelerinin yaklaşık yüzde 99’unu kapsıyor ve yüzde 99,99 doğrulukla sıralandı. Ek olarak, araştırmacıların insan genetik eğitim kitabının anlamını daha iyi anlamalarına yardımcı olmak için proje, model organizmaların genomlarının sıralanmasından tüm genomları incelemek için yeni teknolojiler geliştirmeye kadar çok çeşitli başka hedefler üstlendi. Aşağıda belirtilen hedeflere ulaşmanın yanı sıra, uluslararası araştırmacılar ağı, çoğu bilim insanının çok daha sonraya kadar beklemediği şaşırtıcı bir dizi ilerleme sağladı. Bu “bonus” başarılar şunları içerir: Aralık 2002’de yayınlanan fare genom dizisinin gelişmiş bir taslağı; Kasım 2002’de üretilen sıçan genom dizisinin ilk taslağı; tek nükleotid polimorfizmleri (SNP’ler) olarak adlandırılan 3 milyondan fazla insan genetik varyasyonunun tanımlanması; ve bilinen insan ve fare genlerinin yüzde 70’inden fazlası için tam uzunlukta tamamlayıcı DNA’ların (cDNA’lar) üretilmesi.
Başarılar
| Area | Goal | Achieved | Date |
|---|---|---|---|
| Genetic Map | 2- to 5-cMresolution map (600 – 1,500 markers) | 1-cM resolution map(3,000 markers) | September 1994 |
| Physical Map | 30,000 STSs | 52,000 STSs | October 1998 |
| DNA Sequence | İnsan dizisinin gen içeren kısmının% 95’i% 99,99 doğrulukla tamamlandı | İnsan dizisinin gen içeren kısmının% 99’u% 99,99 doğrulukla tamamlandı | Nisan 2003 |
| Bitmiş Dizinin Kapasitesi ve Maliyeti | Bitmiş baz başına <0,25 ABD Doları ile 500 Mb / yıl dizisi | Bitmiş taban başına <0,09 ABD dolarından yılda> 1,400 Mb / yıl | Kasım 2002 |
| İnsan Dizi Varyasyonu | 100.000 eşlenmiş insan SNP’si | 3,7 milyon eşlenmiş insan SNP’si | Şubat 2003 |
| Gen Tanımlaması | Tam uzunlukta insan cDNA’lar | 15.000 tam uzunlukta insan cDNA | Mart 2003 |
| Model Organizmalar | E. coli, S. Cerevisiae, C. elegans, D. melanogaster’in tam genom dizileri | E. coli, S. cerevisiae, C. elegans, D. melanogaster’in tamamlanmış genom dizileri ve ayrıca C. briggsae, D. pseudoobscura, fare ve sıçan dahil olmak üzere diğer birkaçının tam genom taslakları | Nisan 2003 |
| Fonksiyonel Analiz | Genomik ölçekli teknolojiler geliştirin | Yüksek verimli oligonükleotid sentezi DNA mikrodizileri Ökaryotik, tüm genom nakavtları (maya) Protein-protein etkileşimi için iki hibrit sistemin ölçeğini büyütme | 1994 1996 1999 2002 |
Anahtar Tanımlar
cDNA: cDNA, haberci RNA’dan üretilen sentetik bir DNA türü olan tamamlayıcı DNA’yı veya mRNA’yı ifade eder, protein kodlayan DNA’dan (genlerden) bilgi alan ve ona bir spesifik protein. Bilim adamları, mRNA’yı bir şablon olarak kullanarak, bilgilerini cDNA’ya dönüştürmek için enzimatik reaksiyonları kullanır ve daha sonra onu klonlayarak bir cDNA koleksiyonu veya bir cDNA kütüphanesi oluşturur. Bu kütüphaneler bilim adamları için önemlidir, çünkü insan genomundaki tüm protein kodlayan DNA’nın veya tüm genlerin klonlarından oluşurlar.
cM: cM, bir genetik mesafe birimi olan centiMorgan’ın kısaltmasıdır. Genellikle, bir centiMorgan yaklaşık 1 milyon baz çiftine eşittir.
Ökaryot: Ökaryot, hücreleri farklı bir zara bağlı çekirdek içeren tek hücreli veya çok hücreli bir organizmadır. Bir şey “ökaryotik” olarak tanımlanırsa, zara bağlı çekirdekli hücrelere sahip olduğu anlamına gelir.
Mb: Mb, 1 milyon baz çiftine eşit ve kabaca 1 cM’ye eşit bir uzunluk birimi olan megabase anlamına gelir.
Mikroarray: Mikroarrayler, birçok türde büyük ölçekli genetik analizde kullanılan cihazlardır. Belirli bir dokuda çok sayıda genin nasıl haberci RNA olarak ifade edildiğini ve bir hücrenin düzenleyici ağlarının aynı anda çok sayıda gen pilini nasıl kontrol ettiğini incelemek için kullanılabilirler. Mikrodizi çalışmalarında, fonksiyonel DNA içeren küçük damlacıkları cam slaytlara hassas bir şekilde uygulamak için bir robot kullanılır. Araştırmacılar daha sonra üzerinde çalıştıkları dokudaki tamamlayıcı DNA’ya (cDNA) floresan etiketler eklerler. Etiketli cDNA, slayt üzerinde belirli bir konumda eşleşen DNA dizisine bağlanır. Slaytlar, her bir flüoresan noktanın parlaklığını ölçebilen bir tarama mikroskobuna yerleştirilir. Parlaklık, belirli bir cDNA parçasının ne kadarının mevcut olduğunu ortaya çıkarır ve bir genin ne kadar aktif olduğunun bir göstergesidir. Bilim adamları mikrodizileri birçok farklı şekilde kullanır. Örneğin, mikrodiziler, hücrelerdeki hangi genlerin belirli koşullar altında aktif olarak ürün yaptığına bakmanın yanı sıra sağlıklı ve hastalıklı hücreler arasındaki gen aktivitesindeki farklılıkları saptamak ve / veya incelemek için kullanılabilir.
Oligonükleotid: 10 ila 70 nükleotidlik kısa bir polimer. Bir nükleotid, DNA ve RNA’nın yapısal bileşenlerinden veya yapı taşlarından biridir. Bir nükleotid, bir baz kimyasal – adenin (A), timin (T), guanin (G) veya sitozin (C) – artı bir şeker-fosfat omurgasından oluşur. Oligonükleotidler genellikle tamamlayıcı DNA veya RNA’yı saptamak için problar olarak kullanılır çünkü tamamlayıcılarına kolayca bağlanırlar.
SNP: SNP, tek nükleotid polimorfizmi anlamına gelir. SNP’ler – “kesikler” olarak telaffuz edilir – yaygındır, ancak insan genomunda her 300 bazda bir frekansta meydana gelen küçük değişikliklerdir. Bu, 3 milyar baz çifti insan genomundan 10 milyon pozisyonun ortak varyasyonlara sahip olduğu anlamına gelir. Bu varyasyonlar, ailelerde kalıtımı ve hastalığa yatkınlığı izlemek için kullanılabilir, bu nedenle bilim adamları, diyabet veya kalp hastalığı gibi yaygın hastalıkların nedenlerini ortaya çıkarma çabalarında kullanmak için bir SNP kataloğu geliştirmek için çok çalışıyorlar.
STS: STS, bir genomda yalnızca bir kez oluşan ve bazların tam yeri ve sırası bilinen kısa bir DNA parçası olan sekans etiketli site anlamına gelir. Her biri benzersiz olduğu için, STS’ler birçok farklı laboratuvardan gelen haritalama ve sıralama verilerinin kromozom yerleştirilmesinde yardımcı olur. STS’ler bir genomun fiziksel haritasında yer işaretleri görevi görür.
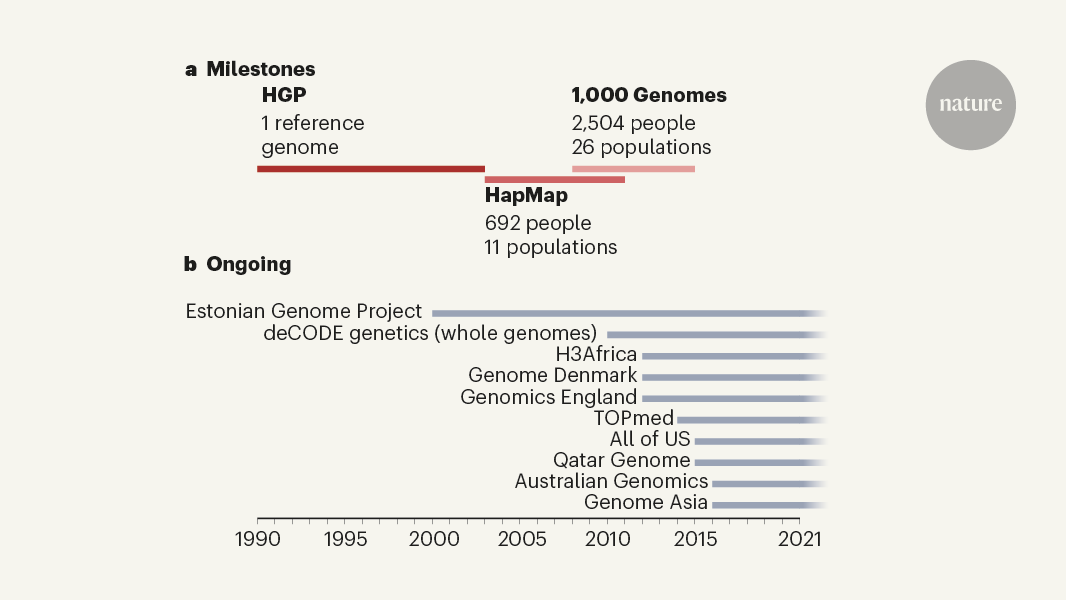
İnsan Genom Projesi Zaman Çizelgesi
Nisan 2003’te tamamlanan İnsan Genom Projesi, bize doğanın bir insan için eksiksiz genetik planını okuma yeteneği verdi. Bu zaman çizelgesi, proje geçmişindeki önemli anları listeler.
1984-86
Aralık 1984’te, ABD Enerji Bakanlığı (DOE) ve Çevresel Mutajenlere ve Kanserojenlere Karşı Uluslararası Koruma Komisyonu (ICPEMC), rekombinant DNA teknolojilerinin artan rolünü vurgulayan “The Alta Summit” ortak sponsoru oldu. Mayıs 1985’te, Kaliforniya Üniversitesi, Santa Cruz Şansölyesi Robert Sinsheimer, insan genom dizilimi üzerine “Santa Cruz Çalıştayı” düzenledi. Mart 1986’da DOE Sağlık ve Çevre Araştırmaları Ofisi, bir İnsan Genom Projesini takip etmenin fizibilitesini değerlendirmek için Santa Fe, New Mexico’da “Genom Dizileme Çalıştayı” düzenledi.
1988
NIH Direktörü James Wyngaarden, İnsan Genomu Projesi için bir plan hazırlamak üzere, Reston, Virginia’da 29 Şubat – 1 Mart 1988 tarihleri arasında bilim adamlarını, yöneticileri ve bilim politikası uzmanlarını bir araya getirdi.
1988
Nisan 1988’de yayınlanan iki rapor, insan genomunu sıralamak için bir çaba yaratılmasını tavsiye ediyor. Ulusal Yaşam Bilimleri Araştırma Konseyi Komisyonu, National Academy Press “İnsan Genomunun Haritalanması ve Sıralanması” nı yayınlamaktadır. ABD Kongresi Teknoloji Değerlendirme Ofisi, Genlerimizin Haritalanması — Genom Projeleri: Ne kadar büyük? Ne kadar hızlı?.”
1988
Ekim 1988’de NIH ve DOE, “insan genomuyla ilgili araştırma ve teknik faaliyetleri koordine etmek” için bir mutabakat zaptı imzaladı. Ayrıca, Sağlık ve İnsan Hizmetleri Sekreteri (HHS) Otis R. Bowen, Direktör James Wyngaarden’in NIH Ofisi bünyesinde İnsan Genomu Araştırma Ofisi’ni kurar.
1989
1 Ekim 1989’da HHS, Amerika Birleşik Devletleri İnsan Genomu Projesi’nin NIH bileşenini yürütmek için Ulusal İnsan Genomu Araştırma Merkezi’ni (NCHGR) kurdu. Merkezin ilk yöneticisi, DNA’nın çift sarmal yapısını birlikte keşfeden James D. Watson’dur.
1989-1990
İnsan Genomu Program Danışma Komitesi, Ocak 1989 toplantısında, insan genomu programının etik, yasal ve sosyal çıkarımları bileşeni için bir plan geliştirmek üzere bir çalışma grubu kurar. Daha sonra NIH-DOE İnsan Genomu Araştırmasının Etik, Hukuki ve Sosyal Etkileri Üzerine Ortak Çalışma Grubu (ELSI Çalışma Grubu) adını alan bu çalışma grubu, ilk toplantısını Eylül 1989’da gerçekleştirdi. Ocak 1990’da, çalışma grubu ilkini yayınladı. bildiri. Çalışma grubu, ELSI programının bireyler ve toplum için insan genomunu haritalama ve dizileme sonuçlarını öngörmesi ve ele alması gerektiğini kabul eder.
1990
Nisan 1990’da, NIH ve DOE beklenen 15 yıllık bir projenin ilk beş yılı için bir plan yayınladı. Projenin hedefleri arasında insan genomunun haritalandırılması ve 3,2 milyar harfin tamamının sırasının belirlenmesi; biyoloji çalışması için önemli olan diğer organizmaların genomlarının haritalanması ve sıralanması; ve DNA’yı analiz etmek için gelişen teknoloji. 1 Ekim 1990’da proje resmi olarak başlıyor. NIH, insan genomunu haritalamak ve sıralamak için gereken bilimsel yaklaşımları, teknolojileri ve kaynakları geliştirmeyi amaçlayan araştırma hibelerine ilk fonları tahsis eder.
1992
10 Nisan’da James Watson, NCHGR’nin ilk müdürü olarak istifa etti. NIH Direktörü Bernadine Healy, Ulusal Kanser Enstitüsü (NCI) hücre biyolojisi laboratuvarı başkanı Michael Gottesman’ı NCHGR direktörü olarak atadı.
1993
4 Nisan 1993’te NIH Direktörü Bernadine Healy, Michigan Üniversitesi Tıp Fakültesi’nden Francis S. Collins‘i ve NCHGR’nin direktörü olarak Howard Hughes Tıp Enstitüsü’nü atadı. Bundan önce Francis Collins, kistik fibroz, Huntingdon hastalığı, nörofibromatoz ve diğer genetik bozukluklardan sorumlu genleri tanımlayan çığır açan araştırmalara öncülük etti. Francis Collins’in Kongredeki Açıklaması
1993
1990 yılında belirlenen hedeflere yönelik hızlı ilerleme nedeniyle, NIH ve DOE 1993 yılında İnsan Genom Projesi için planlanan zamandan iki yıl önce yeni bir hedefler kümesi oluşturdu. Hedefler arasında ayrıntılı genetik ve fiziksel haritalar oluşturmak, sıralama için etkili stratejiler geliştirmek ve Eylül 1998’e kadar teknoloji araştırmalarını teşvik etmek yer alıyor.
1994
Eylül 1994’te İnsan Genom Projesi, kapsamlı bir insan genetik bağlantı haritası olan ilk haritalama hedefine ulaştı. Genetik bağlantı haritaları, kromozomlar üzerinde konumlandırılan, işaretçiler olarak adlandırılan belirli DNA modellerinin göreceli sırasını ve yaklaşık aralığını gösterir. Bu genetik bağlantı haritası, planlanandan tam bir yıl önce projenin bilimsel hedeflerinden birine ulaştı. Genetik bağlantı haritaları, araştırmacıların hastalığa neden olan bir geni bulmak için kullandıkları ilk araçtır. Bu haritalar, geni içeren kromozomun genel alanını tanımlar.
1995
Aralık 1995’te proje, hedeflerinden birini karşıladı, kromozomlar üzerindeki tanımlanabilir yer işaretlerinin gerçek, fiziksel konumlarını içeren fiziksel bir haritayı tamamlamaktı. Fiziksel bir harita, büyük DNA segmentlerinin sıralanmasına yardımcı olmak için yer işaretleri olarak dizi etiketli siteleri kullanır. 1995’teki harita, bu hedef için önemli bir kilometre taşıdır. Fiziksel harita, nihayetinde tam insan genom DNA dizisini birleştirmek için bir omurga görevi görür.
1996
Şubat 1996’da, İnsan Genomu Projesi liderleri Bermuda’daki ilk Uluslararası İnsan Genomu Dizileme Strateji Toplantısında bir araya geldi. Tüm insan genomik sekans bilgilerinin, federal olarak finanse edilen büyük ölçekli insan sıralama merkezleri tarafından oluşturulduktan sonraki 24 saat içinde ücretsiz olarak erişilebilir hale getirilmesi ve kamuya açık alana yerleştirilmesi gerektiğine karar verirler. “Bermuda İlkeleri”, araştırma ve geliştirmeyi teşvik etmek ve İnsan Genomu Projesi’nin topluma faydalarını en üst düzeye çıkarmak için tasarlanmıştır. Bu, deneysel verileri ancak yayınlandıktan sonra kullanılabilir hale getirmeye yönelik bilimsel araştırmadaki standart uygulama ile çelişir. Bu ilkeler, tüm bir endüstrinin uygulamalarını yeniden şekillendirir ve genomik ve diğer alanlarda norm olarak hızlı yayın öncesi veri yayınını belirler. Proje liderleri ertesi yıl Bermuda’da ikinci Uluslararası İnsan Genomu Dizileme Strateji Toplantısında bu ilkeleri onaylamak için yeniden bir araya geldi. Daha İnsan Genomu Dizileme Üzerine Uluslararası Strateji Toplantısı. Dr. Collins’in Notları.
1997
Ocak 1997’de, Sağlık ve İnsan Hizmetleri Bakanlığı Sekreteri Donna E. Shalala, NCHGR’ye yeni bir isim ve diğer NIH araştırma enstitüleri arasında yeni bir statü veren belgeleri imzaladı. Sekreter Shalala’nın yeniden adlandırma konusundaki açıklaması, “Merkezi bir Enstitü olarak belirlemenin, örgütün insan genetik hastalıklarını incelemek ve anlamak için bir NIH odak noktası olarak imajını geliştireceğini ve NHGRI’nin diğer NIH araştırma enstitüleriyle aynı yasama otoriteleri altında faaliyet göstermesine izin vereceğini belirtiyor. “
1998
23 Ekim 1998’de Science, İnsan Genomu Projesi için yeni NIH-DOE beş yıllık planını yayınladı. Önceki beş yıllık planın tüm ana hedefleri karşılandığından, yeni beş yıllık plan insan diziliminin 2003 yılında tamamlanmasını öngörüyor – programdan iki yıl önce. Plan, 2001 yılına kadar insan genomunun bir “çalışma taslağını” oluşturma taahhüdünü yansıtıyor. Ayrıca, “bu [taslak] dizinin boşlukları olacağından, geniş bir alana yayılan DNA özelliklerini incelemek için bitmiş dizi kadar yararlı olmayacağını belirtiyor. bölgeler veya uzun mesafeler boyunca yüksek sıra doğruluğu gerektirir. İnsan dizisinin kullanılabilirliği, büyük ölçekli dizileme ihtiyacını ortadan kaldırmayacaktır. “
1999
Mart 1999’da, uluslararası İnsan Genom Projesi, insan genomunun dizilenmesi pilot aşamasını başarıyla tamamladı ve bir insanın tam genetik planını oluşturan 3 milyar harfin tümünü sıralamak için tam ölçekli çabayı başlattı.
1999
Mayıs 1999’da, ABD ve dünyanın dört bir yanındaki 20 dizileme merkezinden oluşan Uluslararası İnsan Genomu Dizileme Konsorsiyumu liderleri Cold Spring Harbor Laboratuvarı’ndaki bir toplantının ardından, insan dizileme verilerine ücretsiz, anında ve sınırsız erişim sağlama konusundaki taahhütlerini yeniden teyit ettiler. Ayrıca insan genomunu sıralamak için dünya çapındaki çabayı koordine etmenin güçlü yeni yollarını da tanımlarlar. Grup, tüm sekans verilerini derhal kamuya açık alana yerleştirme taahhüdünü yineliyor ve insan genom sekansını bir meta olarak işleme eğilimi kınadı.
1999
Aralık 1999’da, uluslararası bir araştırma ekibi, ilk kez tüm insan kromozomunun genetik kodunu çözme bilimsel kilometre taşına ulaştı. Araştırmacılar, 22. kromozomun DNA’sını oluşturan 33.5 milyon harfin dizisini deşifre ediyorlar. Bir insan kromozomunun organizasyonunu ilk kez bu seviyede görmek, İnsan Genomu Projesi’nin geri kalanının yolunu açıyor. Daha Francis Collins ve Cathy Yarbrough ile 22. kromozom dizisinin önemi üzerine yazışmalar.
2000
26 Haziran 2000’de Uluslararası İnsan Genomu Dizileme Konsorsiyumu, insan genomunun dizisinin bir çalışma taslağını – bir insanın genetik planı – tamamladığını duyurdu. Başkan Bill Clinton, bu başarısını duyurmak için Beyaz Saray’da bir tören düzenledi. Tören, politikacıların, büyükelçilerin, bilim adamlarının, şirket yöneticilerinin, hastalık savunucularının ve gazetecilerin projenin önemli bir kilometre taşını kutlamak için bir araya geldiği Beyaz Saray’ın Doğu Odası’nda gerçekleşir. Daha Francis Collins’in basın toplantısı notları Francis Collins’in Bill Clinton için notları.

2001
12 Şubat 2001’de, Uluslararası İnsan Genomu Dizileme Konsorsiyumu, Nature dergisinde bir taslak dizinin ve insan genomunun ilk analizinin yayınlandığını duyurdu. İnsan genom taslağının ilk analizinden bol miktarda bilgi elde edilir. Örneğin, insan genlerinin sayısının başlangıçta yaklaşık 35.000 olduğu tahmin edilmektedir. (Bu daha sonra yaklaşık 20.000 olarak revize edildi.) Araştırmacılar ayrıca herhangi iki insan bireyin DNA dizilerinin% 99.9 özdeş olduğunu bildirdi. Daha Francis Collins’in basın açıklamasına ilişkin notları Francis Collins’in Nature dergisi için notları.
2003
14 Nisan 2003 tarihinde, Uluslararası İnsan Genomu Dizileme Konsorsiyumu, İnsan Genomu Projesinin başarıyla tamamlandığını duyurdu. Bu, planlanandan iki yıldan fazla ileride. Daha Altı ülkenin hükümet başkanlarının İnsan Genom Dizisinin tamamlanmasıyla ilgili Ortak Bildirisi Başkan Bush’tan Tebrik Mektubu Nisan 2003’ün “İnsan Genom Ayı” Olarak Belirleyen Karar.
2004
20 Ekim 2004 tarihinde, Uluslararası İnsan Genomu Dizileme Konsorsiyumu, tamamlanmış insan genom dizisinin bilimsel açıklamasını yayınladı.
Kaynak: İGP
İnsan Genomu Projesi Tarihi
Science 16 Şubat 2001: Cilt. 291, Sayı 5507, s. 1195 DOI: 10.1126 / science.291.5507.1195
Science ‘s News ekibi, Watson ve Crick’in DNA’nın çift sarmal yapısını keşfetmesinden taslak dizinin bugünkü yayınlanmasına kadar insan genomunu sıralama arayışının tarihini anlatıyor. Bazı klasik bağlantılar içeren bu zaman çizelgesinin bir grafik, interaktif versiyonu, Bilim erken genom döneminden makale ve haberleri de mevcuttur Bilim ‘ın Fonksiyonel Genomik Web sitesine .
1953: (Nisan) James Watson ve Francis Crick , DNA’nın (Doğa ) çift sarmal yapısını keşfettiler .
1972: (Ekim) Paul Berg ve arkadaşları ilk rekombinant DNA molekülünü ( PNAS ) oluşturdu.
1977: Harvard Üniversitesi’nden Allan Maxam ve Walter Gilbert (resimde) ve İngiltere Tıbbi Araştırma Konseyi’nden (MRC) Frederick Sanger , bağımsız olarak DNA dizilimi için yöntemler geliştiriyor ( PNAS , Şubat; PNAS , Aralık).
1980: (Mayıs) Massachusetts Teknoloji Enstitüsü’nden David Botstein , Stanford Üniversitesi’nden Ronald Davis ve Utah Üniversitesi’nden Mark Skolnick ve Ray White , insan genomunun tamamını RFLP’lere ( American Journal of Human Genetics ) dayalı olarak haritalamak için bir yöntem önerdiler .
1982: Şu anda Japonya’da RIKEN’de bulunan Akiyoshi Wada (resimde), otomatik sıralama öneriyor ve Hitachi’nin yardımıyla robotlar oluşturmak için destek alıyor.
1984: (Mayıs) Columbia Üniversitesi’nden Charles Cantor ve David Schwartz , darbeli alan elektroforezi ( Hücre ) geliştirdi.
(Temmuz) MRC bilim adamları, Epstein-Barr virüsünün 170 kb ( Doğa) DNA dizisinin tamamını deşifre etti .
1985: (Mayıs) Robert Sinsheimer (resimde), insan genomunu sıralamanın fizibilitesini tartışmak için Santa Cruz, Kaliforniya Üniversitesi’nde (UC) bir toplantı düzenledi.
(Aralık) Kary Mullis ve Cetus Corp.’taki meslektaşları, büyük miktarda DNA’yı ( Bilim ) kopyalamak için bir teknik olan PCR’yi geliştirdiler .
1986: (Şubat) MRC’den Sydney Brenner , Avrupa Birliği’ni insan genomunu haritalamak ve sıralamak için uyumlu bir program başlatmaya çağırdı; Brenner ayrıca MRC’de küçük bir genom girişimi başlattı.
(Mart) ABD Enerji Bakanlığı (DOE), insan genomunu sıralama planlarını tartışmak için Santa Fe, New Mexico’da bir toplantıya ev sahipliği yaptı.
(Mart) Salk Enstitüsü’nden Renato Dulbecco , bir makalede insan genomunun sıralanmasını teşvik ediyor ( Bilim ).
(Haziran) Bir insan genom projesinin yararları, New York eyaletindeki Cold Spring Harbor Laboratuvarı’ndaki ” Homo sapiens’in Moleküler Biyolojisi” toplantısında hararetle tartışılıyor . ”(Resimde)
(Haziran) Leroy Hood (resimde) ve California Institute of Technology’den (Caltech) Lloyd Smith ve meslektaşları ilk otomatik DNA sıralama makinesini ( Nature ) duyurdu .
(Eylül) Charles DeLisi, DOE’de genom çalışmalarına başladı ve 1987 mali yılı bütçesinden 5.3 milyon doları yeniden tahsis etti.
1987: (Şubat) Walter Gilbert , ABD Ulusal Araştırma Konseyi (NRC) genom panelinden istifa etti ve insan genomunu dizilemek ve telif hakkını almak ve kâr amacıyla veri satmak amacıyla Genome Corp.’u başlatma planlarını duyurdu.
(Nisan) Bir danışma paneli, DOE’nin önümüzdeki 7 yıl içinde insan genomunu haritalamak ve sıralamak için 1 milyar dolar harcaması gerektiğini ve DOE’nin ABD çabalarına öncülük etmesi gerektiğini öne sürüyor. DOE’nin İnsan Genomu Girişimi başlıyor.
(Mayıs) St. Louis’deki Washington Üniversitesi’nden David Burke , Maynard Olson ve George Carle , klonlamaiçin YAC’ler (solda) geliştirerek uç boyutunu 10 kat artırdı ( Bilim ).
(Ekim) Helen Donis-Keller ve Collaborative Research Inc.’deki meslektaşları, 403 işaretli “ilk” genetik haritayı yayınlayarak, kredi ve öncelik ( Cell ) konusunda bir kavgayı ateşledi .
(Ekim) DuPont bilim adamları, floresan zincir sonlandırıcı dideoksinükleotidler ( Bilim ) ile hızlı DNA dizilimi için bir sistem geliştirdi .
Applied Biosystems Inc., Hood’un teknolojisine dayanan ilk otomatik sıralama makinesini piyasaya sundu.
1988: (Şubat) Çok önemli bir raporda, NRC, İnsan Genom Projesi’ni (HGP) onaylayarak aşamalı bir yaklaşım ve yılda 200 milyon dolara kadar hızlı bir ölçeklendirme talep ediyor.
(Haziran) İlk yıllık genom toplantısı Cold Spring Harbor Laboratuvarı’nda yapıldı.
(Eylül) NIH, İnsan Genomu Araştırma Ofisi’ni kurdu ve Watson’ı (resimde) başını çekti. Watson, genom bütçesinin% 3’ünün sosyal ve etik konulardaki çalışmalara ayrılması gerektiğini beyan ediyor.
(Ekim) NIH ve DOE bir mutabakat zaptı imzaladı ve HGP konusunda işbirliği yapmayı kabul etti.
1989: (Ocak) Rockefeller Üniversitesi’nden Norton Zinder , HGP’nin ilk program danışma komitesi toplantısına başkanlık etti.
(Eylül) Olson , Hood , Botstein ve Cantor , STS’leri ( Bilim ) kullanarak yeni bir haritalama stratejisinin ana hatlarını çizdi .
(Eylül) DOE ve NIH, HGP’nin etik, yasal ve sosyal sonuçları üzerine ortak bir komite kurar.
(Ekim) NIH ofisi, hibe verme yetkisiyle Ulusal İnsan Genomu Araştırma Merkezi’ne (NCHGR) yükseltildi.
1990: Üç grupta kapiler elektroforez geliştirildi (solda), bir ekip Lloyd Smith ( Nucleic Acids Research , Ağustos), ikincisi Barry Karger ( Analytical Chemistry , Ocak) ve üçüncüsü Norman Dovichi ( Journal of Chromatography , Eylül) tarafından yönetildi .
(Nisan) NIH ve DOE 5 yıllık bir plan yayınladı. Hedefler arasında eksiksiz bir genetik harita, her 100 kb’de bir işaretleyici içeren fiziksel bir harita ve 2005 yılına kadar model organizmalarda 20 Mb DNA kümesinin dizilenmesi yer alıyor.
(Ağustos) NIH, dört model organizma üzerinde büyük ölçekli sıralama denemelerine başladı: Mycoplasma capricolum , Escherichia coli (sol, pembe), Caenorhabditis elegans (sol, gökkuşağı) ve Saccharomyces cerevisiae(sol, oval). Her araştırma grubu, 3 yıl içinde 75 sent bazında 3 Mb’yi sıralamayı kabul eder.
(Ekim) NIH ve DOE, 1 Ekim’i HGP’nin resmi başlangıcı ilan ederek saati yeniden başlattı.
(Ekim) David Lipman , Eugene Myers ve Ulusal Biyoteknoloji Bilgi Merkezi’ndeki (NCBI) meslektaşları, sekansları hizalamak için BLASTalgoritmasını yayınladı ( Journal of Molecular Biology ).
1991: (Haziran) NIH biyoloğu J. Craig Venter , EST’leri ( Bilim ) kullanarak ifade edilen genleri bulma stratejisini duyurdu . Venter , NIH’nin bu kısmi genlerden binlerce patent başvurusunda bulunduğunu açıkladığında , 1 ay sonra bir kongre duruşmasında bir kavga patlak verir .
(Ekim) Japon pirinç genom dizileme çalışması başladı.
(Aralık) Tennessee’deki Oak Ridge Ulusal Laboratuvarı’ndan Edward Uberbacher , birçok gen bulma programından ( PNAS) ilki olan GRAIL’i geliştirdi .
1992: (Nisan) O zamanki NIH direktörü Bernadine Healy ile kısmi genlerin patentlenmesi konusunda çıkan anlaşmazlığın ardından Watson , NCHGR başkanlığından istifa etti.
(Haziran) Venter , Rockville, Maryland’de kar amacı gütmeyen Genomik Araştırma Enstitüsü’nü (TIGR) kurmak için NIH’den ayrıldı. William Haseltine , TIGR ürünlerini ticarileştirmek için kardeş şirketi Human Genome Sciences’a başkanlık ediyor.
(Temmuz) İngiltere’nin Wellcome Trust, HGP’ye 95 milyon dolarla girdi.
(Eylül) Caltech’ten Mel Simon ve arkadaşları klonlama için BAC’ler ( PNAS ) geliştirdiler.
(Ekim) ABD ve Fransız ekipleri, kromozomların ilk fiziksel haritalarını tamamladılar: Whitehead Enstitüsü’nden David Page ve meslektaşları (resimde) Y kromozomunu ( Bilim ) haritaladı ; Centre d’Etude du Polymorphisme Humain’den (CEPH) Daniel Cohen ve Généthon ve meslektaşları kromozom 21’i ( Doğa ) haritaladı .
(Aralık) Uzun tartışmalardan sonra, NIH ve DOE veri ve kaynakların paylaşılmasına ilişkin yönergeler yayınladı, hızlı paylaşımı teşvik etti ve araştırmacıların verileri 6 ay boyunca gizli tutmasını sağladı.
ABD ve Fransız ekipleri fare ve insanın genetik haritalarını tamamladı: fare, ortalama işaret aralığı 4.3 cM , Eric Lander ve Whitehead’deki meslektaşları ( Genetics , Haziran); insan, ortalama işaret aralığı 5 cM, Jean Weissenbach ve arkadaşları CEPH’de ( Nature , Ekim).
1993: (Nisan) Michigan Üniversitesi’nden Francis Collins , NCHGR’nin müdürü oldu.
(Ekim) NIH ve DOE, 1993–98 için gözden geçirilmiş bir plan yayınladı. Hedefler, 1998’in sonuna kadar 80 Mb DNA’nın dizilenmesini ve insan genomunun 2005 yılına kadar tamamlanmasını içeriyor.
(Ekim) Wellcome Trust ve MRC, İngiltere, Cambridge’in güneyindeki Hinxton Hall’da Sanger Center’ı açtı John Sulstonliderliğindeki (resimde) merkez, uluslararası konsorsiyumdaki en önemli sıralama laboratuvarlarından biri haline geldi.
(Ekim) GenBank veritabanı resmi olarak Los Alamos’tan NCBI’ye taşınıyor ve NIH ve DOE’nin kontrol konusundaki mücadelesine son veriyor.
1994
(Eylül) Iowa Üniversitesi’nden Jeffrey Murray , Généthon’dan Cohenve meslektaşları, ortalama 0.7 cM’lik işaret aralığı ( Science ) ile insan genomunun eksiksiz bir genetik bağlantı haritasını yayınladılar .
1995: (Mayıs – Ağustos) Richard Mathies ve UC Berkeley ve Amersham’daki meslektaşları iyileştirilmiş sekanslama boyaları geliştirdi ( PNAS , Mayıs); Amersham’daki Michael Reeve ve Carl Fuller , termostabil polimeraz geliştirir ( Nature , Ağustos).
(Temmuz) TIGR’den Venter ve Claire Fraser ve Johns Hopkins’den Hamilton Smith , serbest yaşayan bir organizma olan Haemophilus influenzae’nin 1.8 Mb ( Science ) ilk sekansını yayınladılar .
(Eylül) Japon hükümeti, 5 yıl içinde toplam 15.9 milyon dolarlık çeşitli sıralama gruplarını finanse ediyor: Tokai Üniversitesi, Tokyo Üniversitesi ve Keio Üniversitesi.
(Ekim) Stanford’dan Patrick Brown ve meslektaşları, tamamlayıcı DNA (cDNA) problarının ( Science ) basılı bir cam mikro dizisini kullanarak ilk makaleyi yayınladılar .
(Aralık) Whitehead ve Généthon’daki araştırmacılar (Whitehead’de Lander ve Thomas Hudson liderliğindeki ), insan genomunun 15.000 işaret ( Science ) içeren fiziksel bir haritasını yayınladılar .
1996: (Şubat) Wellcome Trust tarafından finanse edilen Bermuda’daki bir toplantıda, uluslararası HGP ortakları, sekans verilerini 24 saat içinde kamuya açık veritabanlarına yayınlamayı kabul etti.
(Nisan) NIH, insan genomunun büyük ölçekli dizilişini denemek için altı gruba fon sağlıyor.
(Nisan) Affymetrix, DNA çiplerini ticari olarak satışa sundu.
(Eylül) DOE, BAC klonlarının uçlarını sıralamak için toplam 5 milyon $ ‘dan finanse edilen altı pilot proje başlattı.
(Ekim) Uluslararası bir konsorsiyum, maya S. cerevisiae’nin ( Bilim ) tüm genom dizisini kamuoyuna açıkladı .
(Kasım) Yoshihide Hayashizaki’nin RIKEN’deki grubu ilk tam uzunlukta fare cDNA setini tamamladı.
1997: (Ocak) NCHGR, Ulusal İnsan Genomu Araştırma Enstitüsüne terfi etti; DOE, Ortak Genom Enstitüsü’nü oluşturur.
(Eylül) Fred Blattner , Guy Plunkett ve Wisconsin Üniversitesi, Madison, meslektaşları E. coli , 5 Mb ( Science ) DNA dizisini tamamladı .
(Eylül) Molecular Dynamics , bir kılcal sıralama makinesi olan MegaBACE’i tanıttı .
1998: (Ocak) NIH, SNP’leri bulmak için yeni bir proje duyurdu.
(Şubat) Japonya, ABD, AB, Çin ve Güney Kore temsilcileri, pirinç genomunu sıralamak için uluslararası bir işbirliği için yönergeler oluşturmak üzere Japonya’nın Tsukuba kentinde bir araya geldi.
(Mart) Washington Üniversitesi’nden Phil Green (resimde) ve Brent Ewing ve meslektaşları, sıralayıcı verilerini otomatik olarak yorumlamak için phred adlı bir program yayınladılar ( Genetik Araştırma ). Hem phred hem de onun kardeş programı phrap (dizileri bir araya getirmek için kullanılır) 1995’ten beri yaygın olarak kullanılıyordu.
(Mayıs) PE Biosystems Inc., PE Prism 3700 kapiler sıralama makinesini tanıttı.
(Mayıs) Venter , Celera adlı yeni bir şirketi duyurdu ve insan genomunu 3 yıl içinde 300 milyon dolara sıralayacağını açıkladı.
(Mayıs) Yanıt olarak Wellcome Trust, HGP’ye olan desteğini ikiye katlayarak 330 milyon dolara çıkardı ve sıralamanın üçte birinin sorumluluğunu üstlendi.
(Ekim) NIH ve DOE, 2001 yılına kadar insan genomunun “çalışma taslağını” oluşturmaya yönelik yeni bir hedefle HGP’yi aşırı hızda çalıştırdılar ve bitmiş taslağın tamamlanma tarihini 2005’ten 2003’e kaydırdılar.
(Aralık) Sanger Center’dan Sulston ve Washington Üniversitesi’nden Robert Waterston ve meslektaşları C. elegans’ın ( Bilim ) genomik dizisini tamamladı .
1999: (Mart) NIH, kaba taslağın tamamlanma tarihini tekrar 2000 baharına taşıdı. Büyük ölçekli dizileme çabaları, Whitehead, Washington Üniversitesi, Baylor, Sanger ve DOE’nin Ortak Genom Enstitüsü’ndeki merkezlerde yoğunlaştı.
(Nisan) On şirket ve Wellcome Trust, verileri üç ayda bir kamuya yayınlamayı planlayan SNP konsorsiyumunu başlattı.
(Eylül) NIH, fare genomunu sıralamak için 3 yılda 130 milyon dolar ayıran bir proje başlattı.
(Aralık) İngiliz, Japon ve ABD’li araştırmacılar, 22 numaralı ( Nature ) bir insan kromozomunun ilk dizisini tamamladılar .
2000: (Mart) Celera ve akademik işbirlikçileri, meyve sineği Drosophila melanogaster’ın(solda) 180 Mb genomunu sıraladı , bu genom şimdiye kadar dizilenmiş ve Venter’ın tartışmalı tüm genom av tüfeği yönteminin ( Bilim ) bir doğrulaması .
(Mart) Bir veri yayınlama politikası konusundaki anlaşmazlık nedeniyle, HGP ve Celera için önemli bir keskin nişancılık ortasında iş birliği yapmayı planlıyor.
(Mayıs) Alman ve Japon araştırmacılar tarafından yönetilen HGP konsorsiyumu, kromozom 21’in ( Doğa ) tam dizisini yayınladı .
(Haziran) Bir Beyaz Saray töreninde, HGP ve Celera ortaklaşa insan genom dizisinin çalışma taslaklarını duyururlar, sonunda kan davalarını ilan ederler ve eşzamanlı yayın sözü verirler.
(Ekim) DOE ve MRC , Mart 2001’e kadar kirpi balığı, Fugu rubripes (solda) genomunu sıralamak için ortak bir proje başlattı .
(Aralık) Uluslararası bir konsorsiyum, ilk bitki olan Arabidopsis thaliana (solda), 125 Mb’nin dizilişini tamamladı .
(Aralık) HGP ve Celera’nın Science dergisinde ortak yayın planları çöktü; HGP, makalesini Nature’a gönderir .
2001: (Şubat) HGP konsorsiyumu çalışma taslağını Nature’da yayınladı (15 Şubat) ve Celera taslağını Science’ta yayınladı (16 Şubat).