
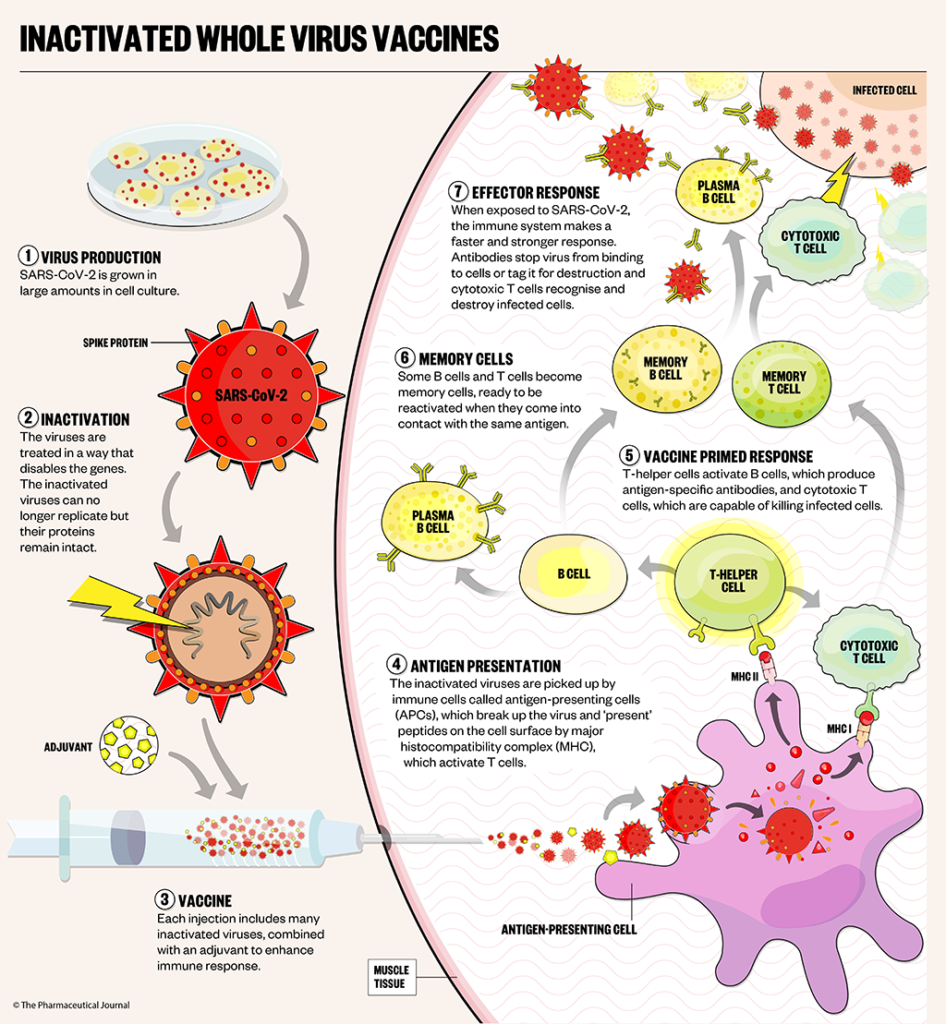
Aşağıda, “öldürülmüş” ya da diğer bir terimle “inaktive” edilmiş virüs aşıları ile ilgili geniş (kimyasından koruyuculuğuna kadar) bir derlemenin Türkçe çevirisini göreceksiniz… Her ne kadar virüsler cansız yaoılar olsalar da, metin boyunca inaktif virüsler yerine zman zaman “ölü virüs” terimi kullanılmıştır. Ülkemizde de görünüşe bakılırsa, toplumsal olarak ilk yapılacak olan koronavirüs (SARS-CoV-2 virüsüne karşı) aşısı, ölü virüs aşısı olacağından, konunun önemine binaen…! Bol sabır…
Klasik olarak, insan ve hayvanları klinik ve virolojik olarak korumak için iki ana aşı türü kullanılır: modifiye edilmiş canlı virüs (zayıflatılmış virüs) aşıları ve öldürülmüş virüs (inaktive edilmiş virüs) aşıları.
Daha güvenli oldukları için öldürülmüş virüs aşıları genellikle daha çok tercih edilirler, ancak kullanımında bazı sorunlarla karşılaşılabilir.
Birincisi, virüs inaktivasyonu yeterince olmamış ise aşılamadan sonra salgınlar olabilir. İkincisi, viral nötralize edici epitoplar inaktivasyon sırasında yok edilebilir ve bu da zayıf bir nötralize edici antikor yanıtı ve patojen tehditine karşı zayıf bir koruma ile sonuçlanır. Bu nedenle, etkisizleştirilmiş antijenin etkili kalite kontrolü yapılmalı, virüs etkisizleştirmesini ve etkisizleştirme prosedürünün epitopları nötralize etme üzerindeki etkisi iyi değerlendirilmelidir.
Aşağıda, virüsler için farklı ve en yaygın olarak kullanılan inaktivasyon prosedürleri ve bunların bir ölü virüs aşısının geliştirilmesindeki faydaları verilmiştir. Tartışılan inaktivasyon yöntemlerine ve ilgili kimyasal koşullar Tablo 1’de verilmiştir.
| Metot | Tip | Mekanizma |
| Formaldehit | Alkilleyici ajanÇaprazbağlayıcı | Adenin monohidroksimetilasyonuRNA’nın kapsid proteinlerine çapraz bağlanması, genom okunmasını bloke ederHidroksimetillenmiş aminler arasında moleküller içi ve moleküller arası metilen köprüleri oluşturarak proteinlerin çapraz bağlanması |
| Glutaraldehit | Çaprazbağlayıcı | Proteinlerin formaldehit ile aynı mekanizma ile çapraz bağlanması (aşağıda açıklanmıştır) |
| Dithiodipidin | Çaprazbağlayıcı | S-H gruplarının oksidasyonu ile proteinlerin çapraz bağlanması, S-S köprülerinin oluşumuna neden olur, bu da S-H içeren dahili viral proteinlerin kovalent modifikasyonu ve fonksiyonel inaktivasyonu ile sonuçlanır. |
| Propiolakton | Alkilleyici ajanÇaprazbağlayıcı | Bir konsensüs mekanizması olarak RNA ve DNA’nın alkilasyonuProteinlerin çapraz bağlanması |
| Etilen imin | Alkilleyici ajan | Düşük konsantrasyonlarda RNA ve DNA’nın alkilasyonu. Büyük olasılıkla genom okuması, etilen imin tarafından guanin veya adenin alkilasyonu ile bloke edilir.Yüksek konsantrasyonlarda proteinlerin (nükleokapsid) alkilasyonu |
| pH | Denatürasyon ajanRNA parçalanması | Viral fonksiyonel aktif proteinlerin denatürasyonuHidroksil grubunun her nükleotid arası bağlantının fosfor merkezine yakınlığı, kuvvetli asidik veya kuvvetli bazik koşullar altında transesterifıkasyonu kolaylaştırır ve sonuç olarak fosfodiester bağının kırılması gerçekleşir |
| Sıcaklık | Denatürasyon ajanRNA parçalanması | Yüksek sıcaklık viral aktif proteinleri denatüre eder”Düşük” sıcaklıkta (41 °C’nin altında) virüs inaktivasyonunun, nükleik asidin bozunmasından kaynaklandığı düşünülmektedir. |
| Gamma radyasyon | Radyasyon | Virüsler, genomun bozulması yoluyla doğrudan hasarla etkisiz hale getirilir.Proteinlere zarar veren serbest radikallerin oluşumu |
| Ultraviyole ışık | Radyasyon | RNA’da bitişik urasiller arasında dimer oluşumunun tetiklenmesi. Dimer oluşumu, şeker omurgasında basınç ve kırılmaya neden olur. Böylece, genom okuma bloke edilir.Daha yavaş çalışır, ultraviyole ışık ayrıca kapsid proteinlerinde yapısal değişikliklere, büyük ve küçük fotoürünlerin oluşumuna neden olur. |
Çapraz bağlayıcılar
Formaldehit
Formaldehit ile inaktivasyona dayalı ölü virüs aşısı geliştirme birçok virüs için araştırılmıştır. Bunlardan birkaçı aşağıda tartışılmıştır. Formaldehit ile etkisizleştirilmiş bazı aşılar iyi çalışır ve tehdit durumunda hastalığa karşı korur. Bunlar arasında, inaktive Ross River virüsü (RRV), Batı Nil virüsü, dang-2 virüsü, tip 1 herpes virüsü, papilloma virüsü, Hantaan virüsü, influenza (grip) virüsü, hepatit A virüsü, kene kaynaklı ensefalit (beyin iltihabı) virüsü ve Japon ensefalit virüsü. Ancak bazı aşıların bu şekilde etkisiz hale getirilmesi ile sorunlar yaşanmıştır. Başarısızlığın nedenleri hakkında fikir sahibi olmak için kimyanın daha ayrıntılı bir şekilde anlaşılması gerekir.
Suda seyreltildiğinde formalin olarak da bilinen formaldehit (Şekil 1A), elektron eksikliği olan bir merkezi karbon atomuna sahiptir ve bu nedenle, rezonans formlarından biriyle gösterildiği gibi elektrofiliktir (elektron çekim merkezli). Sonuç olarak, protonsuz bir amino (NH2) grubu gibi bir nükleofil (proton çekim merkezli) merkezi karbonil karbona saldırabilir. Bu kimyasal reaksiyona tip 1 ekleme denir.
Formaldehitin hem genom hem de proteinler üzerinde etkisi vardır. Her şeyden önce, monohidroksimetilatlar adenin: adenin (N6) üzerindeki protonlanmamış ekzosiklik amin bir nükleofil gibi davranır ve formaldehitin karbokatyonu ile reaksiyona girer. Bu nükleofilik ekleme nedeniyle adenin monohidroksimetillenmiştir ve bu da genom okumasını bloke eder. Alkilasyon olarak da bilinen adeninin bu monohidroksimetilasyonu (Şekil 1A), DNA veya RNA üzerinde meydana gelebilir. Monohidroksimetiladenin (NH-CH2OH) oda sıcaklığında günlerce kararlıdır ve Schiff bazından (N = CH2) daha çok bulunur. Bununla birlikte, adenin ve formaldehit oda sıcaklığında ve 4.5 pH’ta günlerce saklanırsa metilen bis-adenin oluşabilir.

Formaldehit ayrıca, N-terminal amino asitinde protonlanmamış amino grupları ve yan zincirlerinde N içeren lizin, arginin, glutamin, triptofan ve histidin veya yan zincirlerinde bir sülfhidril grubu içeren sistein gibi işlevselliğe sahip amino asitlerle reaksiyona girebilir. Daha spesifik olarak, lizin yan zinciri (Şekil 1B) için örnek olarak gösterildiği gibi, protonlanmamış bir amin, bir nükleofil gibi davranır ve formaldehitin karbokatyonu ile reaksiyona girer. Sonuç olarak, amino grubu, yukarıda adenin için açıklandığı gibi monohidroksimetillenmiştir. Kararsız hemiaminalden bir su molekülünün kaybı, aynı zamanda bir imin ara ürünü olarak da adlandırılan Schiff bazı oluşumuyla sonuçlanır. Elde edilen Schiff bazı veya imin ara ürünü, nükleofilik bir ekleme reaksiyonu ile arginin ve tirozin ile ve daha az ölçüde glutamin, asparagin, triptofan ve histidin amino asitleri ile çapraz bağlanabilir. Bu şekilde, moleküller içi ve moleküller arası metilen köprüleri oluşturulabilir (Şekil 1B). Bu köprüler nedeniyle, proteinler moleküller içi ve moleküller arası çapraz bağlanır.
Ayrıca bu reaksiyonlar, transkripsiyon mekanizmasının genoma ulaşmasını önleyen yukarıda açıklanan işlevsellikleri birleştirerek genom ve proteinler arasında çapraz bağlanmaya da neden olabilir.
Formaldehit ile gözlenen sorunlardan biri, formaldehit inaktivasyonuna dayalı bazı aşılarda, eksik insktivasyondan dolayı aşılama sonrası virüs enfeksiyonlarının salgınları başgösterebilir. Bu durum, şap hastalığı virüsü (FMDV) ve Venezuela at ensefalit virüsü (VEEV) gibi çeşitli virüsler için bildirilmiştir. Moleküler analiz, 1980’lerde Batı Avrupa’da FMDV ve 1970’lerde Orta Amerika’da VEEV salgınlarının, tamamen inaktive edilmiş virüs aşılarının bir sonucu olduğunu açıkça kanıtladı. Bu durum, nükleokapsid proteinlerinin RNA ile çapraz bağlanmasından kaynaklanıyor olabilir. Sonuç olarak, RNA bozunamaz ve bazı virüs partikülleri formaldehit ile inaktivasyondan kaçar. Güvenlik testinin yeterli olmaması ve bu virüsleri uygun şekilde etkisiz hale getirmek için daha yüksek bir formaldehit konsantrasyonunun gerekliliği de olasıdır. Şiddetli akut solunum sendromu koronavirüsünün (SARS-CoV) formaldehit inaktivasyonunu incelenmiş ve formaldehitin virüsü sıcaklığa bağlı bir şekilde etkisiz hale getirebileceği gösterilmistir. Virüs, 3 gün sonra bile 4 °C gibi düşük bir sıcaklıkta inaktive edilememiştir. Bununla birlikte, 25 veya 37 °C gibi daha yüksek bir sıcaklık kullanıldığında, formaldehit, virüsün çoğunu 1 gün sonra inaktive edebilir. Sıcaklığa ek olarak, inaktivasyon sırasındaki pH da önemli bir rol oynayabilir (bkz. “PH” bölümü). SARS-CoV 48 saat boyunca % 0.05 formaldehit ile uygun şekilde inaktive edilebilir. Formaldehit ile inaktive edilmiş SARS-CoV aşılarının virüse özgü ve virüs nötralize edici antikorları indüklediği gösterilmiştir; ancak, bazı virüsler inaktivasyonun 3. gününde hala bulaşıcı kalmıştır.
Formaldehit inaktivasyonuna dayalı bazı ölü virüs aşıları, virüsü nötralize edici bir antikor yanıtı indüklemez. Örneğin solunum sinsitiyal virüs (RSV), inaktive HIV, SIV ve VEEV aşıları virüse karşı koruma sağlamazlar. Aşılama sırasında zayıf bir bağışıklık tepkisi oluşur ve aşılanan bireylerde enfeksiyondan sonra atipik veya gelişmiş hastalığa bile yol açabilir. Bu durum, büyük olasılıkla, virüs ve antikorlar arasında immün komplekslerin oluşumu ile birlikte nötralize edici antikor yanıtlarının zayıf indüksiyonundan ve bu komplekslerin monositik hücreler tarafından alınmasını ve enfeksiyonunu daha da kolaylaştırmasından kaynaklanmaktadır. Buna, “antikora bağlı gelişmiş enfeksiyon” adı verilir. Bu durum, inaktive edilmiş kızamık ve RSV aşılarında gözlenir.
Formaldehit, viral yapıyı yok edebilir ve bu da zayıf bir bağışıklık tepkisine neden olabilir. Poliovirüs (PV) formaldehit ile tedavi edildiğinde, antijenik bölgelerin modifikasyonunun kapsamı, kullanılan suşa bağlıdır ve indüklenebilecek immün yanıt ile ilişkilidir. Domuz üreme ve solunum sendromu virüsünün (PRRSV) formaldehit ile muamelesi virüsü inaktive eder, ancak viral girişle ilişkili alanları korumaz. Nötralize edici antikorlar, PRRSV reseptörlerine bağlanmada ve konakçı hücreye içselleştirmede rol oynayan viral epitoplara yönlendirildiği için, bu alanlar koruyucu bağışıklığın indüksiyonu için önemli olabilir. Viral girişle ilişkili alanların çapraz bağlanması, adaptif immün sistem hücrelerine viral nötrleştirici epitopların sonraki sunumuna müdahale edebileceğinden, bu prosedür inaktive edilmiş PRRSV aşısı gelişimi için yararlı değildir. Formaldehit ile inaktivasyon üzerine virion yapısının modifikasyonu FMDV, HIV ve canine parvovirus için de bildirilmiştir.
Sonuç olarak, formaldehitin bazı virüsleri doğru bir şekilde etkisiz hale getirdiği gösterilmiş olsa da, yukarıda tartışılan problemler göz önüne alındığında, kullanılan protokolün tam olarak dikkate alınması gerekir. Kısmen, bazı hatalar yetersiz bir inaktivasyon protokolünden kaynaklanıyor olabilir. Ölü virüs aşısı gelişimi için inaktivasyon yöntemi kullanılırken, eksik virüs inaktivasyonu gibi salgınlara yol açan problemler akılda tutulmalıdır. Formaldehit, bazı virüsler için ölü virüs aşısı geliştirmek için kullanılabilir, ancak formaldehit inaktivasyonuna dayalı birkaç ölü virüs aşısı, virülan virüs tehdidinde konağı korumaz. Bu durum PV, FMDV ve HIV için bildirildiği gibi, RNA-protein çapraz bağlanması veya formaldehit tarafından viral proteinlerin modifikasyonu nedeniyle olabilir.
Glutaraldehit
her ne kadar sadece birkaç örneği varsa da, glutaraldehit ile tam virüs inaktivasyonu formaldehit ile olduğundan daha az sorunlu görünmektedir.
Glutaraldehit (Şekil 2) doymuş, beş karbonlu bir dialdehittir. Karbonil karbonlar elektrofiliktir ve bu nedenle protonsuz bir amino grubu gibi bir nükleofil, formaldehit gibi nükleofilik bir ekleme reaksiyonunda bu karbonlara saldırabilir.
Genomik DNA veya RNA, glutaraldehitin hedefidir. Kesin etki mekanizması açık bir şekilde tanımlanmamış olsa da, formaldehit ve glutaraldehit üzerinde benzer kimyasal gruplar bulunduğundan, glutaraldehitin formaldehit ile aynı şekilde etki etmesi muhtemeldir. Adenin (N6) üzerindeki ekzosiklik amino grubu, glutaraldehite saldıran reaktif gruptur. RNA ve protein sentezi bu aldehit tarafından bloke edilebileceğinden glutaraldehidin genom üzerinde bir etkisi olabileceği kesindir.

Glutaraldehit proteinler üzerinde de bir etkiye sahip olabilir, çünkü lizin gibi amino asitlerin protonlanmamış aminleri birbirleriyle çapraz bağlanabilir. Ancak glutaraldehidin proteinlerle reaksiyon mekanizması formaldehitinkinden farklıdır (Şekil 2). İlk olarak, glutaraldehit, aldol yoğunlaşması ve suyun uzaklaştırılmasıyla doymamış aldehitler oluşturur. Daha sonra, birkaç amino asit, bir nevi ekleme yoluyla glutaraldehite bağlanabilir, protonlanmamış aminler nükleofiller olarak işlev görür ve glutaraldehit oligomerinin çift bağıyla reaksiyona girer. Bu şekilde, amino asitler bir köprü oluşturularak birleştirilir. Formaldehit ile reaksiyonun aksine, ara Schiff bazları veya iminler oluşmaz, ancak her iki yol da kovalent olarak bağlı amino asit yan zincirleri ile sonuçlanır.
Ek olarak, yukarıda açıklanan reaksiyonlar genom ve proteinlerin çapraz bağlanmasına da neden olabilir, bu da genomun okunmasını bloke eder.
Glutaraldehit ile virüs inaktivasyonunu araştırmak için SARS-CoV, iki farklı dilüsyonda ve farklı sıcaklıklarda glutaraldehit ile inkübe edilmiş ve glutaraldehitin SARS-CoV’yi sıcaklık bağımlılı olarak inaktive etme kabiliyetinde olduğu sergilenmiştir. Virüs, 3 gün sonra bile 4 °C’de glutaraldehit ile inaktive edilememiştir. Bununla birlikte, 25 veya 37 °C’lik daha yüksek bir sıcaklık kullanıldığında, virüs sırasıyla 2 ve 1 gün içinde inaktive olmuştur.
Glutaraldehit iki işlevli veya aldol yoğunlaşmasından sonra çok işlevli çapraz bağlama sağladığından, virüse hasarı daha geniş olabilir. Bu nedenle, koruyucu bir bağışıklık tepkisinin indüksiyonu, glutaraldehit ile inaktive edilmiş virüs aşılarında daha fazla sorun olabilir. Ördek HBV (DHBV) ve sığır RSV (BRSV), glutaraldehit kullanımının bir ölü virüs aşısı üretimi için test edildiği virüslerdir. Glutaraldehit ile inaktive edilmiş DHBV ve BRSV, virüse özgü antikorlar geliştirmiştir, ancak glutaraldehit ile inaktive edilmiş DHBV ile aşılanmış ördekler ve glutaraldehit ile inaktive edilmiş BRSV ile aşılanmış kuzular, yüklemeden sonra viremiye karşı tam olarak korunmamıştır. Bu durum, bu hayvanlarda koruyucu bağışıklık indüksiyonu olmadığını gösterir.
Viral yapının glutaraldehit tarafından tahrip edilmesi bir problem olabilir. Formaldehite benzer şekilde, glutaraldehit PRRSV’yi inaktive edebilir, ancak viral girişle ilişkili bölgeleri korumaz ve bu nedenle inaktive edilmiş PRRSV aşısı geliştirmek için yararlı değildir. Glutaraldehidin ayrıca enfeksiyöz bussal hastalık virüsünün konformasyonel yapısını değiştirdiği de gösterilmiştir.
Sonuç olarak glutaraldehit, virüsleri uygun şekilde etkisiz hale getirebilir, ancak burada tartışılan ölü virüs aşıları için her zaman enfeksiyona karşı koruma yoktur. Bu durum, viral proteinlerin glutaraldehit tarafından yok edilmesinden kaynaklanıyor olabilir.
Aldrithiol veya 2,2´-ditiodipiridin
Aldrithiol, ditiodipiridin (AT-2) ile virüs inaktivasyonu ölü virüs aşıları için bir prosedür, HIV, PRRSV ve RSV için araştırılmıştır.
AT-2, S-H gruplarını oksitleyerek proteinleri çapraz bağlayan S-S köprülerinin oluşumuna neden olur (Şekil 3). Aromatik tiyolat daha iyi ayrılan grup olduğundan, reaksiyon dengesi alifatik disülfidlere doğru kayar. Dahili viral proteinler, hücre içi (indirgeyici) ortama tabi tutulur ve bunun bir sonucu olarak sistein tortuları, tiyol formunda (S-H) bulunur. Bunun tersine, virüslerin yüzey proteinleri hücre dışı (oksitleyici) ortama maruz kalır ve sonuç olarak sisteinler disülfidler (S-S) olarak bulunur. AT-2 ile muamele, HIV enfeksiyonu için gerekli olan nükleokapsid protein gibi S-H içeren dahili viral proteinlerin kovalent modifikasyonu ve fonksiyonel inaktivasyonu ile sonuçlanırken, disülfid bağlı sisteinli zarf glikoproteinleri etkilenmeden kalır.

AT-2 ile etkisiz hale getirilen HIV preparatları, saptanabilir enfektiviteyi korumamış, ancak konformasyonel ve fonksiyonel bütünlüğün korunduğunu göstermiştir. Bu durum, bu tür viryonların aşı antijenleri olarak faydalı olabileceğini düşündürmektedir. AT-2 inaktivasyonuna dayalı bir RSV aşısının, sıçanların akciğerlerinde virüs replikasyonuna karşı korunma sağladığı bulunmuştur. Bu durum, retrovirüsleri nükleokapsid proteinlerindeki çinko parmak motifini hedef alarak inaktive eden bileşiklerin RSV’ye karşı da etkili olduğunu göstermektedir.
Ancak AT-2 tüm virüsleri etkisiz hale getiremez. PRRSV, AT-2’ye duyarlı değildir ve inaktive edilemez. PRRSV için, nükleokapsid proteinleri arasındaki disülfid blokları virüs enfeksiyonu için önemlidir, ancak yukarıda belirtildiği gibi, bu disülfür köprüleri AT-2’den etkilenmeden kalır. PRRSV’de enfeksiyon için önemli olan serbest tiol grupları yok gibi görünüyor. Muhtemelen, sadece serbest tiyol gruplarının virüs enfeksiyonu için önemli olduğu virüsler AT-2 tarafından etkisiz hale getirilebilir.
Aşılamadan sonra tam korumanın sağlanamadığı bazı aşılama çalışmaları da vardır. AT-2 ile inaktive edilmiş SIV ile yapılan bir aşılama çalışması, bir immün yanıtın indüklenebileceğini ve homolog (ancak heterolog olmayan) virüs ile tehditte virolojik koruma olduğunu gösterdi.
Sonuç olarak, AT-2, viryon yapısının korunmasıyla HIV ve SIV’i düzgün bir şekilde etkisiz hale getiriyor gibi görünmektedir, ancak aşılama çalışmaları, AT-2 ile etkisizleştirilmiş virüsün konakçıyı tehditten koruyabileceğini kanıtlayamaz. AT-2 diğer virüslerle etkili bulunmamıştır.
Alkilleyici ajanlar
β-propiolakton
β-propiolakton (BPL), aşı amacıyla virüsleri inaktive etmek için yaygın olarak kullanılır. Bu madde esas olarak viral DNA veya RNA guanini üzerinde bir alkilleme ajanı olarak görev yapar. Şekil 4’te gösterildiği gibi, nükleik asitlerin nükleofilik guanini, gergin BPL’nin halka açılmasına ve guaninin N-alkilasyonuna neden olan bir nükleofilik ikame mekanizması vasıtasıyla elektrofilik BPL ile reaksiyona girer. BPL, bir kanserojen olarak çok daha toksik olduğundan ve “Aminoetil etilen imin” bölümünde tartışılan ikili etilen imin (BEI) ile aynı etki modunu sergilediğinden, ilgilenen okuyucu daha ilgili literatüre bakabilir. İlginç bir şekilde, BPL tedavisinin mekanik ayrıntıları ve kimyasal modifikasyonları, son zamanlarda nükleo-baz, nükleosit ve peptit model sistemleri üzerinde sistematik çalışmalar yoluyla açıklığa kavuşturulmuş, yukarıdaki G-alkilasyon konsensüs yolunu gözden geçirmiş ve ilgili kimyaya daha nüanslı bir bakış sağlamıştır. Aslında, asilasyon ve çapraz bağlanma reaksiyonları, önemli ölçüde, proteinler (çoğu reaktif olarak sistein, metiyonin ve histidin), daha önceki literatürde kabul edildiğinden daha kapsamlı bir şekilde modifiye edildiğinde meydana gelir ve bu, aşı üretimi için ciddi sonuçlar doğurabilir. Aslında, BPL tedavisi ile amino asitler üzerindeki modifikasyonlar, örneğin, influenza virüslerinin hücrelere virüs-membran füzyonu ve hemaglutinin modifikasyonu yoluyla girme durumuna yol açabilir.

Sarı humma, SARS-CoV, grip ve kuduza karşı BPL ile inaktive edilmiş virüs aşıları, nötralize edici antikorların üretimini indükleyebilmiştir. Bununla birlikte, BPL ile inaktive edilmiş influenza, azalmış hemaglutinin ve nöraminidaz aktivitesi göstermiştir. SARS-CoV, hematopoietik nekroz virüsü (HNV) ve influenzaya karşı BPL ile inaktive edilmiş virüse dayanan aşılar, tehdide karşı koruma sağlamıştır.
Sonuç olarak BPL, virüsleri uygun şekilde etkisiz hale getiriyor ve koruyucu bir bağışıklık tepkisi oluşturabiliyor. BPL, viral genomu alkilleyebildiği için bu beklenebilir bir sonuçtur. Bununla birlikte, BPL kullanılırken protein modifikasyonu akılda tutulmalıdır.
Aminoetil etilen imin
Etilen iminlerle virüs inaktivasyonu ilk olarak 30 yıldan daha uzun bir süre önce tanıtıldı. Başlangıçta, kimyasal olarak benzer iki bileşik (etilen imin (aziridin) ve asetiletilen imin) inaktif virüs aşılarının geliştirilmesinde kullanılmak üzere önerilmiştir. Bununla birlikte, aziridinin nükleik asitlere karşı seçiciliği çok yüksek değildir. Bu seçiciliği iyileştirmek için, daha fazla protonize edilebilir amino grubuna sahip bir ürün gerekliydi ve aynı zamanda BEI olarak da adlandırılan aminoetil etilen imin, iki protonize edilebilir amino grubuna sahipken aziridinde sadece bir tane vardı.
Düşük konsantrasyonda BEI kullanılırsa, virüs kapsidi alkillenmez, ancak BEI kapsidden geçer ve genomu alkiller. Genomun N7-guanini bir nükleofil gibi davranır ve elektrofil BEI ile reaksiyona girer. N7-guanin tarafından gerçekleştirilen nükleofilik ikame reaksiyonu BEI halkasının açılmasına neden olur ve guanin alkillenir (Şekil 5).

Ek olarak, adenin, BEI ile bir halka açma reaksiyonu yoluyla alkillenir. RNA nükleozidlerindeki bu halka açma reaksiyonu, DNA nükleositlerindekinden yaklaşık iki ila üç kat daha hızlıdır. Şimdiye kadar, BEI’nin proteinlerle herhangi bir etkileşimi hakkında rapor bulunmamaktadır, en azından düşük konsantrasyonlar kullanılıyorsa, bu da nötralize edici viral epitopların bir virüsün BEI ile muamelesinden sonra korunduğunu göstermektedir.
BEI, FMDV, RRV, koyun çiçeği, HIV, Nipah virüsü, HNV ve PRRSV gibi birçok virüsün inaktivasyonu için kullanılır.
Yukarıda bahsedildiği gibi, düşük BEI konsantrasyonunun kullanılması halinde viral yapının korunması bir sorun teşkil etmemelidir. Bu aynı zamanda, BEI’nin viral girişle ilişkili alanların korunmasıyla PRRSV’yi inaktive edebildiği PRRSV için de gösterilmiştir. Dahası, FMDV’nin BEI ile inaktivasyonu, FMDV’nin antijenitesini etkilememiştir.
BEI ile inaktive edilmiş virüse dayalı çoğu aşı, koruyucu bir immün tepkisi indükleyebilir. Saflaştırılmış BEI ile inaktive edilmiş RRV aşısı ile aşılanan fareler, canlı virüs tehdidine karşı korunmuştur. Aşı, test edilen tüm fare türlerinde önemli düzeyde nötralize edici antikor indüklemiştir. BEI ile etkisiz hale getirilmiş bir koyun çiçeği virüsü suşu, aşılamadan 1 hafta sonra başlayarak tehditten 4 hafta sonrasına kadar virüse özgü antikorları indükleyebilir. Aşılanmış kuzular, aşılamadan sonraki 6 aya kadar virüs tehdidinden korunmuştur. BEI ile inaktive edilmiş HIV aşısının hem homolog aşı suşuna hem de heterolog bir virüs suşuna karşı virüsü nötralize edici antikorları indüklediği gösterilmiştir. Ayrıca, virüse özgü antikorlar, BEI ile inaktive edilmiş Nipah virüsüne karşı indüklenebilir; ancak, bunlar in vitro virüsü nötralize etmemiştir. Domuzların BEI ile inaktive edilmiş PRRSV ile aşılanmasından sonra, tehditten sonra viremiyi azaltabilen, virüse özgü ve virüsü nötralize eden bir antikor yanıtı verdikleri gösterilmiştir.
Sonuç olarak, BEI’nin virüsleri düzgün bir şekilde inaktive ettiği görülmüştür ve BEI inaktivasyonuna dayalı çoğu ölü virüs aşısı, virülan virüs ile yüklemeden sonra konakçıyı korur. Çünkü BEI, düşük konsantrasyon kullanılırsa virüs yapısına etki etmez.
Denatüre edici prosedürler
pH
pH’ı yükseltmek veya düşürmek, protein denatürasyonu üzerinde etkilidir. Bu durum, proteinlerin farklı bir 3 boyutlu yapı benimsediği anlamına gelir. Düşük (asidik) veya yüksek (alkali) bir pH, proteinlerin ikincil yapılarının denatürasyonu yoluyla virüsleri inaktive edebilir, böylece bir konakçı hücreye bağlanma ve replikasyona dahil olan viral proteinlerin konformasyonunu değiştirebilir. Koronavirüslerin başak proteinlerinin yapısı, örneğin pH 8’de değişir ve sonuç olarak virüsün konakçı hücreye girişi başlar, ancak daha düşük veya daha yüksek bir pH reaktivite kaybıyla ilişkilidir.
PH ayrıca genomik düzeyde de etkiye sahiptir (Şekil 6). RNA hidroksil grubunun her nükleotid arası bağlantının fosfor merkezine yakınlığı, güçlü asidik veya güçlü bazik koşullar altında transesterifıkasyonu kolaylaştırır. Baz katalizli reaksiyonlar, oksijenin bitişik fosfor merkezine saldırdığı ve sonuç olarak fosfodiester bağının kırıldığı nükleofilik bir ekleme mekanizması yoluyla ilerler (Şekil 6).

Bugüne kadar, ölü virüs aşıları için virüslerin inaktivasyonunda kullanılmış aşırı pH koşulları ile ilişkili bir rapor bulunmamaktadır. Ancak SARS-CoV için inaktivasyon kinetiği yapılmıştır. SARS-CoV’nin bulaşıcılığı, aşırı pH değerlerine duyarlıdır, çünkü 5 ila 9 arasındaki orta dereceli pH değişimleri virüsü inaktive edemezken, aşırı alkali (pH 12 ve 14) veya aşısı asidik (pH 1 ve 3) koşullar virüsü inaktive etmiştir.
Virüsler aşırı pH koşullarında inaktive edilirse, viral yapının korunması bir sorun oluşturabilir. PH’ı değiştirerek PRRSV inaktivasyonu virüsü inaktive edebilir, ancak PRRSV üzerindeki viral girişle ilişkili alanları (bölgeleri) korumaz. Bu durum, en azından PRRSV’de, pH’ı değiştirerek inaktivasyonun uygun bir ölü virüs aşısı oluşturmak için uygun olmadığını göstermektedir.
Sonuç olarak, aşırı pH, virüsleri inaktive edebilir, ancak bu inaktivasyon yöntemine dayanan bir ölü virüs aşısının, tehdide karşı koruma açısından etkisi bilinmemektedir. pH inaktivasyonuna dayalı bir aşıda, virüs yapısı yok edilebileceğinden zayıf bir bağışıklık tepkisi vermesi mümkündür.
Sıcaklık
Virüsler ısıtılarak veya pastörize edilerek, viral proteinlerin ikincil veya üçüncül yapılarının denatürasyonu ile etkisiz hale getirilebilirler. Bu süreçte, bir konakçı hücreye bağlanma ve çoğalmasında rol alan viral proteinlerin konformasyonunun değişmesi mümkündür. Virüslerin nükleik asitlerindeki fosfodiester bağının kırılması yoluyla RNA degradasyonu meydana gelir (Şekil 6). “Düşük” sıcaklıklarda (41 °C’nin altında) virüs inaktivasyonunun, nükleik asidin degradasyonundan kaynaklandığı düşünülürken, “yüksek” sıcaklıkta virüs inaktivasyonu protein denatürasyonu ile ilişkilidir.
Isı inaktivasyonu, SARS-CoV, HIV ve HNV için bir ölü virüs aşısı geliştirme yöntemi olarak çalışılmıştır. Isının SARS-CoV’yi inaktive etme yeteneğini test etmek için virüs üç sıcaklıkta (56, 65 ve 75 °C) inkübe edilmiş, 56 ve 65 °C’de virüsün çoğunun inaktive olduğu görülmüştür. Bununla birlikte, bazı virüsler, tahlil tespit limitine yakın bir seviyede bulaşıcı kalmıştır, bu da bazı virüs partiküllerinin 56 ve 65 °C’de kararlı olduğunu göstermektedir. Bu sonuç için olası bir açıklama, yavaşça ayrışan agregatların varlığı olabilir. Virüs 56 ve 65 °C’de, 60 dakikalık inkübasyonda bile tam olarak inaktive edilmiş olmasına rağmen, 45 dakikalık inkübasyondan sonra 75 °C’de tamamen inaktive olmuştur. Birlikte ele alındığında, bu sonuçlar pastörizasyon yoluyla viral inaktivasyonun, maruz bırakma yeterince uzunsa çok etkili olabileceğini göstermektedir.
Viral yapının korunması için, yüksek bir sıcaklığın viral proteinler üzerinde bir etkisi olduğu öne sürülürken, 41 °C’nin altındaki bir inaktivasyon sıcaklığının protein seviyesi üzerinde hiçbir etkisinin olmadığı ileri sürülmüştür. In vitro enfeksiyon tahlilleri ve western blot analizi, PRRSV durumunda virüsün hücreye girişle ilişkili alanlarında 37 °C’de maruz bırakılmadan sonra korunduğunu ve virüsün artık replike olmadığını göstermiştir. Ancak, ısı ile inaktive edilmiş influenza virüsü (> 55 °C), hemaglutinin ve nöraminidaz aktivitesini kaybetmiştir.
Nötralize edici antikorların indüksiyonu ve aşılamadan sonra koruma söz konusu olduğunda, sonuç aşıya bağlıdır. BALB/c fareleri ve rhesus makakları (Macaca mulatta), 62 °C’de inaktive edilmiş HIV numuneleri ile aşılandığında, ilk aşılamadan sonra virüse özgü antikorlar gözlenmiştir. Ayrıca, serumların aşı suşunu nötralize edebilen antikorlar içerdiği bulunmuştur. Bununla birlikte başka bir çalışmada, 50 °C’de inaktive edilen HNV, balıkları korumamıştır.
Sonuç olarak, sıcaklığın virüsleri inaktive edebileceği, ancak inaktive edilmiş örneklerde bazı ısıya dayanıklı partiküllerin kalabileceği gösterilmiştir. Isıyla inaktive edilmiş bazı aşılar, nötralize edici bir antikor tepkisi oluşturabilirken diğerleri hastalığı önleyememiştir. Bu durum muhtemelen protein modifikasyonundan kaynaklanmaktadır, çünkü yüksek bir inaktivasyon sıcaklığı kullanılmıştır. Protein modifikasyonları istenmiyorsa inaktivasyon sıcaklığı 41 °C’nin altında olmalıdır.
Işınlara maruz bırakma
Morötesi (ultraviyole) ışık
Dalga boyuna bağlı olarak, Ultraviyole (UV) ışık üç sınıfa ayrılır: UVA (320–400 nm), UVB (280–320 nm) ve UVC (200–280 nm). UVC, RNA ve DNA bazları tarafından emilir ve iki bitişik pirimidin (urasil ve timin) arasında dimer oluşumuna yol açabilir (Şekil 7). UVB ayrıca pirimidin dimer oluşumunu da indükleyebilir, ancak UVC’den 20 ila 100 kat daha az etkilidir. UVA, RNA ve DNA tarafından zayıf bir şekilde emilir ve pirimidin dimerlerini UVB ve UVC’den çok daha az verimli bir şekilde oluşturur.
Bu nedenle, genel olarak UV, iki bitişik veya karşıt pirimidin arasında pirimidin dimerlerinin oluşumuna neden olur. İki pirimidin, bir perisiklik 2π – 2π siklokatlama reaksiyonu yoluyla reaksiyona girerek bir siklobütan halkasının oluşmasına neden olur (Şekil 7). Dimer, genomun şeker omurgasında belirli bir gerginliğe neden olur ve bu da muhtemelen genomda kırılmalara yol açar. Ek olarak, UV radyasyonuyla oluşturulan urasil dimerler, bir transkripsiyon şablonu olarak RNA molekülünü inaktive eder.

Virüs inaktivasyonu için bu prosedür, tavşan hemorajik hastalık virüsü (RHDV), murin lösemi virüsü suşu Cas-Br-M ve PRRSV gibi virüslere karşı bir ölü virüs aşısı geliştirmek için test edilmiştir.
UV ile inaktive edilmiş virüslere dayalı bazı aşılar bir bağışıklık tepkisi oluşturabilir. UV ile inaktive edilmiş murin lösemi virüsü suşu Cas-Br-M (UV-Cas), yeni doğan NFS/N farelerinde güçlü, Cas’a özgü sitotoksik T-lenfosit tepkisini indüklemiştir. UV-Cas ile aşılama, fareleri hastalığa karşı korumuş ve virüs replikasyonunu azaltmıştır. Ayrıca, UV ile inaktive edilmiş PRRSV ile domuzların aşılanması, yüklemeden sonra viremiyi azaltabilen virüse özgü ve virüsü nötralize edici antikor yanıtlarını indüklemiştir.
Bununla birlikte, virüs enfeksiyonuna karşı koruma sağlamayan UV etkisizleştirilmiş aşılar da vardır. UV ile inaktive edilmiş RHDV ile aşılanan ve virülan virüs ile muamele edilen tavşanlar, yüklemeden sonra 82 saat içinde ölmüştür. Ölüm anında hiçbir antikor tespit edilememiştir.
UV inaktivasyonundan sonra viral yapının korunması açısından dikkatli olmak gerekir. UV, viral girişle ilişkili protein alanların korunmasıyla PRRSV’yi inaktive edebilir, ancak bu tüm virüsler için geçerli değildir. Mengovirüs enfeksiyonu, muhtemelen viral RNA’daki dimer oluşumuna bağlı olarak, UV ışınlamasına maruz kalındığında çok hızlı bir şekilde kaybolur. RNA ve DNA üzerindeki bu hızlı etkinin yanı sıra, UV ışınlaması aynı zamanda kapsid proteinlerinde yapısal modifikasyonlara neden olur, bu da çok daha yavaş bir süreç olan büyük ve küçük fotoürünlerin oluşumuna neden olur. UV ışınlarına maruz kalmış reovirüs için de büyük fotoürün proteinlerinin oluşumu bildirilmiştir.
Sonuç olarak, UV radyasyonunun virüsleri uygun şekilde etkisiz hale getirdiği gösterilmiştir. Virüs yapısı inaktivasyondan sonra korunursa, bu UV ile inaktive edilmiş virüse dayalı ölü virüs aşısı, konakçıyı tehditten koruyabilir. Bununla birlikte, UV inaktivasyonuna dayalı bazı ölü virüs aşıları, virülan virüs ile yüklemeden sonra konağı korumaz. Bu, viral proteinlere müdahale eden fotoürünlerin oluşumundan kaynaklanıyor olabilir.
Yorum
Aşı amaçlı virüs inaktivasyonu için önemli olan bazı konular tanımlanmıştır. Bir ölü (inaktif) virüs aşısının geliştirilmesinde önemli bir adım, virüsün dengeli bir inaktivasyonudur. Tüm virüs partiküllerinin tamamen inaktive edilmesi gerekir, ancak inaktivasyon yönteminin viral antijenik özellikler üzerinde sadece küçük bir etkisi olmalıdır, çünkü konakçının bağışıklık sistemi antijene karşı nötralize edici antikorlar üretmek için nötrleştirici epitopları tanımak zorundadır. Antikor tepkisi çoğunlukla aşılama çalışmalarında araştırıldığından, bu inceleme aşılama sırasında antikorların indüksiyonuna odaklanmıştır. Bununla birlikte, hücre aracılı immün yanıt üzerindeki etki de çok önemlidir ve aday aşılar değerlendirilirken daha derinlemesine araştırılmalıdır. Virüs inaktivasyonunun yanı sıra virüs yapısının korunması, bir ölü (inaktif) virüs aşısı geliştirilirken akılda tutulması gereken bir sorun olabilir.
İlk olarak, inaktivasyon süreci sırasında, inaktivasyondan kaçan virüslere yol açabilecek olası virüs tortularının oluşumunun farkında olunmalıdır. Tek bir virüs titrasyonu her zaman kaçan virüsü tespit etmez. İnaktive edilmiş bir virüs aşısının güvenliğini araştırmak için bir kalite kontrol sistemi, muamleye tabi tutulan virüsün in vitro ortamdan geçirilmesiyle elde edilebilir ve bu durum, virüs inaktivasyonunun tamlığı hakkında daha fazla bilgi verebilir. Aşı ancak böyle bir testi geçerse, aşı güvenliğini doğrulamak için başka hayvan deneyleri düşünülebilir.
İkincisi, bir ölü virüs aşısının geliştirilmesinde virüs yapısının korunması çok önemlidir. Çapraz bağlayıcılar veya denatüre edici prosedürler gibi viral proteinlere etki eden inaktivasyon prosedürleri, nötralize edici antikorların indüksiyonu için gerekli olan viral-nötrleştirici epitopları değiştirebilir. Bu nedenle, viral proteinleri etkilemeyen yöntemlerle ölü virüs aşıları için virüsün inaktive edilmesi daha iyidir. Radyasyon ve alkilleyici ajanlar gibi esas olarak genom üzerine etki eden inaktivasyon prosedürleri, büyük olasılıkla viral-nötralize edici epitopları koruyacaktır ve tercih edilmelidir. Bununla birlikte, inaktivasyondan sonra protein degradasyonu her zaman kontrol edilmelidir.
Antijen kalitesini araştırmak için farklı kalite kontrol sistemleri mevcuttur. İnfluenza için inaktivasyonun etkisi inaktivasyondan önce ve sonra hemaglutinasyon aktivitesi ölçülerek araştırılır. ELISA, etkisizleştirmeden sonra nötralize edici antikorların viral epitoplara bağlanmasının belirlenmesi için kullanılabilir. Bu durum, HIV, kuduz virüsü ve PV aşılarının antijenlerinin kalite kontrolü olarak kullanılır. Bununla birlikte, önceki yöntemler için, nötralize edici epitopların bilgisi gereklidir. Bazen nötralize edici epitoplar bilinmemektedir. Virüs nötralize edici antikorlar genellikle virüs girişine dahil olan viral proteinlere yönelik olduğundan, virüs nötralize edici bir antikor tepkisini indüklemek için virüs girişi ile ilişkili alanların korunması önerilebilir. Bu bağlamda, inaktive edilmiş virüsün antijen kalitesini araştırmak için bir kalite kontrol sistemi, bir virüsün girişle ilişkili alanlarının korunduğunu teyit ederek geliştirilebilir. Bu durum, immünofloresan boyama ve konfokal mikroskopi ile virüs inaktivasyonundan önce ve sonra virüsün konakçı hücrelere eklenmesi ve içselleştirilmesi araştırılarak elde edilebilir.
Sonuç olarak, belirli bir aşı virüsünü etkisiz hale getirmek için potansiyel olarak uygun birçok yöntem geliştirilmiştir, ancak bu yöntemlerin başarısı, belirli virüse ve kullanılan koşullara (yani sıcaklık, pH ve konsantrasyon) bağlı olarak değişebilir. Bununla birlikte, aşı geliştirme için bir virüsü etkisiz hale getirmeye yönelik başarılı yöntemler en iyi, esas olarak genom üzerinde bir etkiye sahip olan yöntemlerden seçilir. Formaldehit, glutaraldehit, pH ve ısı, protein seviyesi üzerinde bir etkiye sahip olduğundan, nötralize edici epitopların çapraz bağlanma (formaldehit veya glutaraldehit) veya denatürasyon (pH veya sıcaklık) yoluyla modifiye edilmesi mümkündür. Bu inaktivasyon prosedürleri esas olarak genomu hedeflediğinden ve viral proteinler üzerinde hiç veya çok az etkiye sahip olmadığından, bir ölü virüs aşısı oluşturmak için ve bir virüsü inaktive etmek için UV ışınlaması, gama radyasyonu, BPL ve BEI en başarılı yöntemlerdir. Bununla birlikte, viral proteinlerin BPL ile çapraz bağlanabileceği veya UV foto ürünleri ve gama ışıması ile oluşan serbest radikaller tarafından zarar görebileceği dikkate alınmalıdır. Ancak radyasyon hedefi teorisi, biyomoleküllerin radyasyon duyarlılığının kütlelerine bağlı olduğunu öngörür. Bu nedenle, önemli ölçüde daha düşük kütleye sahip viral genomlar, proteinlere göre hasara karşı önemli ölçüde daha duyarlı olacaktır.
Yakın zamana kadar, etkili bir ölü virüs aşısı arayışı, genellikle bir virüsün belirli bir inaktivasyon yöntemiyle inaktive edildiği ve daha sonra tam virüs inaktivasyonunu, aşılamada antikor tepkisini ve tehdit üzerine korumayı araştırmak için hayvanlarda hemen test edildiği bir deneme yanılma süreciydi. Şu anda, virüs inaktivasyonunun (güvenlik) ve antijen kalitesinin (bağışıklık tepkisi) araştırılabileceği bir kalite kontrol sisteminin oluşturulmasına izin veren bir dizi in vitro araç mevcuttur. Bu şekilde aşı etkinliği, hayvan deneylerinden önce tahmin edilebilir. Sonuç olarak, eksik virüs inaktivasyonuna bağlı salgınlar ve viral protein yıkımına bağlı zayıf bağışıklık tepkileri mümkün olduğu kadar önlenebilir.
Viral genom üzerindeki ana etkilerini ortaya koyan virüs etkisizleştirme yöntemlerinin, etkili bir bağışıklık tepkisi üretmede ve konakçıyı hastalığa karşı korumada en büyük potansiyele sahip olduğu görülmektedir. İnaktive edilmiş bir PRRSV aşısı için bir kalite kontrol sistemini takiben birkaç inaktivasyon yönteminin in vitro testinde, mevcut yöntemlerden sadece birkaçının virion yapısının korunmasıyla tam virüs inaktivasyonuna izin verdiği görülmüştür. Değerlendirilen bu yöntemlerin moleküler ve mekanik temeli göz önüne alındığında, hepsinin esas olarak viral genomu etkilediği ve viral proteinleri etkilenmeden bıraktığı açıktır. Bu nedenle, sağlam bir virion yapısını garanti edebilecek viral genom inaktivasyonuna dayalı ölü virüs aşıları için yöntemler geliştirmek, uygun bir bağışıklık tepkisinin ve hastalığa karşı korumanın indüksiyonu için çok önemlidir.
Ana Kaynak: Inactivated virus vaccines from chemistry to prophylaxis: merits, risks and challenges

Hiç yorum yok:
Yorum Gönder