Kanser hücreleri kendilerini gizleme mekanizmaları kullanarak, bağışıklık hücrelerinin onları bulup yok etmesini zorlaştırır. Tümörler ayrıca bağışıklık hücrelerini baskılayan proteinleri ifade ederek bağışıklık hücrelerinin saldırısından kendilerini korurlar
Geçen yılın (2018) Nobel Fizyoloji ve Tıp Ödülü konusu (immünoterpai) güncelliğini koruyor ve bu yazıya da biraz gecikmiş bir şey olarak bakılabilir… (bu konuda eski bir yazım burada okunabilir).
Nobel komitesi, 2018 Nobel Tıp Ödülü’nün, “negatif bağışıklık düzenlemesini engelleyerek kanser tedavisini keşfettikleri için” MD Anderson Kanser Merkezi’nden James P. Allison ve Kyoto Üniversitesi’nden Tasuku Honjo’ya verildiğini duyurdu.

İki araştırmacı da 1990’larda, farklı yöntemleri kullanarak bağışıklık sistemine bir ince ayar yapılmasının ve böylece önde gelen bağışıklık hücrelerinden T hücrelerinin kanser hücrelerine saldırmanın mümkün olabileceğini gösterdiler.
Biraz tarihçe…
Bağışıklık sistemini kansere hücrelerine karşı harekete geçirmek uzun zamandır üzerinde düşünülen bir konu.
19. yüzyılın sonlarında, New York’lu kanser cerrahı William Coley, sarkoma (bağ dokusu) lezyonlarına streptokok bakterilerini bilerek enjekte etti ve bunun yol açtığı enflamasyonun hastalığın yayılmasını geçici olsa da kontrol edebileceğini keşfetti. Ancak, zamanla cerrahi (kesme), radyoterapi (yakma) ve kemoterapinin (ilaçla zehirleme) gelişimi ile bu fikir bir yana bırakıldı…
Buna rağmen, immünoterapi tamamen terk edilmedi ve son yüzyıl boyunca kanser araştırmacıları kanser ve bağışıklık sistemi arasındaki etkileşimi keşfetmeye devam etti.
İmmünoterapi, bağışıklık sistemini aktive ederek veya baskılayarak hastalığın tedavisidir. Bir immün yanıtı ortaya çıkarmak veya arttırmak için tasarlanan immünoterapiler, aktivasyon immünoterapileri olarak sınıflandırılırken, indirgeyen veya baskılayan immünoterapiler, supresyon immünoterapileri olarak sınıflandırılır.
Tüberküloz aşısı olarak kullanılan basil Calmette-Guérin (BCG) erken dönem mesane kanserli hastaların mesanesine enjekte edildiğinde hastalık kontrol altına alınabiliyordu ve bu 1970’lerde yaygın bir uygulama haline geldi. Benzer şekilde, bağışıklık sisteminin sinyal molekülleri olan interferon-alfa ve interlökin-2 gibi sitokinlerin uygulanması, melanomun (bir çeşit deri kanseri) cerrahi sonrası tedavisinde yaygın kullanıldı ve bazı kanserlerde sağ-kalımı arttırdı. Ne yazık ki, bu tür tedavilerden faydalananlar küçüktü ve bazı hastalarda yan etkiler görülüyordu.
Sitokinler (ör. interlökinler ve interferonlar), hücreler (özellikle bağışıklık hücreleri) arasında sinyal iletiminde önemli geniş bir protein/peptid kategorisidir. Sitokinler lipit çift katmanını geçip sitoplazmaya giremezler. Dolayısı ile etkilerini hücre yüzeyinde sergileyip ikincil yollarla hücrenin davranışını etkilerler. Interlökinler (.ör. IL-2) beyaz kan hücrelerinin bir çeşidi olan ve bağışıklık tepkisinde önemli rolü olan T hücreleri tarafından üretilen proteinlerdir. Yüksek dozlarda IL’ler T hücrelerini aktive ederk kanser hücrelerini tanıma ve bunlara saldırma olasılıklarını arttırır.
Son yıllarda, kanser immünoterapisine yönelik çok sayıda araştırmanın odağını sitotoksik T lenfositleri ve bunların kanserli hücrelerle olan etkileşimleri oluşturdu. Beyaz kan hücrelerinin bir grubu olan bu hücreler oldukça spesifik yüzey reseptörlerine sahiptir. Bu reseptörler, yüzeylerinde belli protein parçaları bulunan hücrelere (dendritik hücreler) bu parçalar aracılığı (MHC kompleksi) ile bağlanabilirler.
MHC Kompleksi, kazanılmış bağışıklık sistemi rol alan ve omurgalılarda yabancı molekülleri tanımak için gerekli hücre yüzeyi proteinleri olup doku uyumluluğunu belirler.
İnsanlarda boyun kısmında bulunan bir bez olan timusta gelişen T lenfositler normal doku ve organları tanır ve bu doku ve organlardaki hücrelere saldırmaz. Aksi taktirde kandan temizlenirler (bu olmazsa otoimmün hastlıklar gelişir). Bu nedenle, sağlıklı bireylerde virüsler tarafından enfekte olan veya kanser gelişiminin erken döneminde mutasyona uğramış proteinler içerenler (yani kendine ait olmayan peptidlere sahip hücreler) T lenfosit saldırısına uğrarlar.
Yabancı ajan (ör. patojen) ve hücrelere (ör. kanser hücreleri) bağlandıklarında, lenfositler tehlikeyi kontrol etmek ve ortadan kaldırmak için o hücrelerde hücre ölümü sürecini başlatırlar. Bu işlem sürekli devam eder ve kötü huylu değişime yol açabilecek fonksiyon bozukluğu belirtileri gösteren hücreleri ortadan kaldırır. Ancak, etkilenen hücreler bu kontrolden çıkabilir ve kanserde olduğu gibi kontrolsüz şekilde büyüyebilirler. Tüm vücut sistemleri gibi, bağışıklık sistemi de aşırı aktivasyonu önlemek ve bir tehlikeyi temizledikten sonra eşik seviyesine dönmek için karmaşık mekanizmalara sahiptir. Bu durum, sağlıklı dokulardaki aşırı bağışıklık saldırısı nedeniyle kişinin zarar gördüğü otoimmün hastalık riskini önlemek için önemlidir.
Tekrar 2018 Nobel Tıp Ödülü alan çalışmaya dönersek…
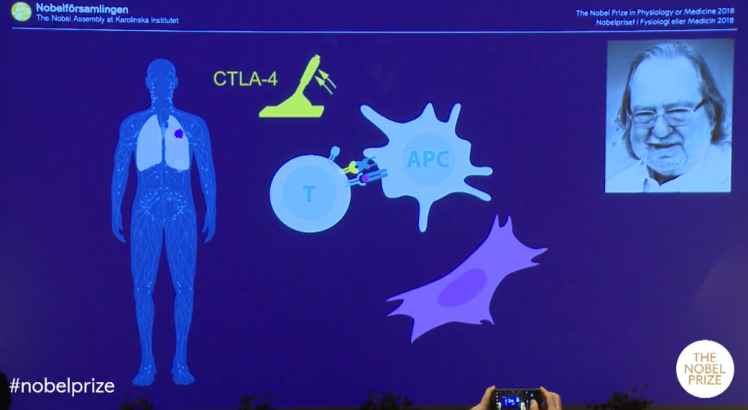
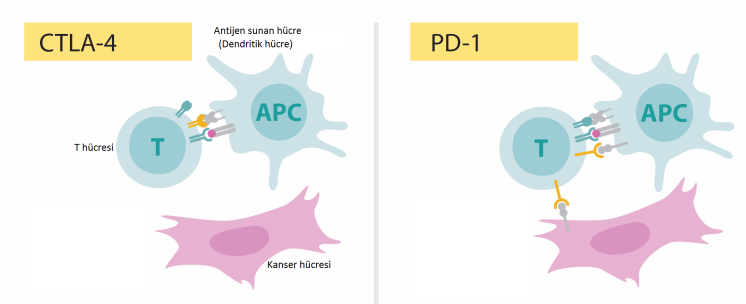
Allison, bağışıklık sisteminde fren görevi gören CTLA-4 adı verilen ve T hücreleri üzerinde bulunan bir proteini (antijen olarak çalışan bir protein) çalıştı. CTLA-4, daha önceleri otoimmün hastalıklarda bir hedef olarak kullanılmışsa da, kanserde de bunun hedef seçilmesi ilk onun fikri olmuş!
Dendritik hücreler adı verilen özel bir immün hücre sınıfı tarafından sitotoksik T lenfositlerin aktivasyonunu araştırırken, Allison, sitotoksik T lenfosit ile ilişkili protein 4 (CTLA-4) reseptörünün işlevini tanımladı. Çoğu araştırmacı, T hücreleri ile dendritik hücreler arasındaki etkileşimleri aktive edici olarak düşünürken, Allison, tam tersi olarak CTLA-4 ile etkileşimi inhibe edici olarak tanımladı.
CTLA-4, aktive T lenfositlerin yüzeyinde ifade edilir ve bu mekanizma kontrolsüz aktivasyonun önlenmesi ve böylece otoimmüniteden zarar görmesini önlemek için bağışıklık sistemi üzerinde bir sınırlama oluşturur. Allison, inhibe edici CTLA-4 ile dendritik hücreler üzerindeki tetikleyici arasındaki etkileşimi spesifik bir antikor kullanarak bloke etti. Bu deneyin sonuçları çarpıcıydı; fareler tümörleri yok edebiliyor ve hayatta kalabiliyordu.
Allison, CTLA-4’e bağlanan ve böylece onu devre dışı bırakan bir antikor (ticari adı Ipilimumab veya Yeryov) geliştirdi… Böylece T hücrelerinin yüzeyindeki bu fren serbest kaldığını ve bağışıklık hücrelerinin akın akın gelip ve tümörleri yok edebildiğini keşfetti.
Aşağıda Honjo’nun çalışmasında bahsedeceğimiz gibi, Allison da sonuçlarının önemini fark etti. Geliştirdiği Ipilimumab adlı antikor ilaç insanlarda denendiğinde sonuçlar kayda değerdi. Bu müdahale, metastatik melanomalı hastalarda sağkalımı önemli ölçüde arttırıyordu.
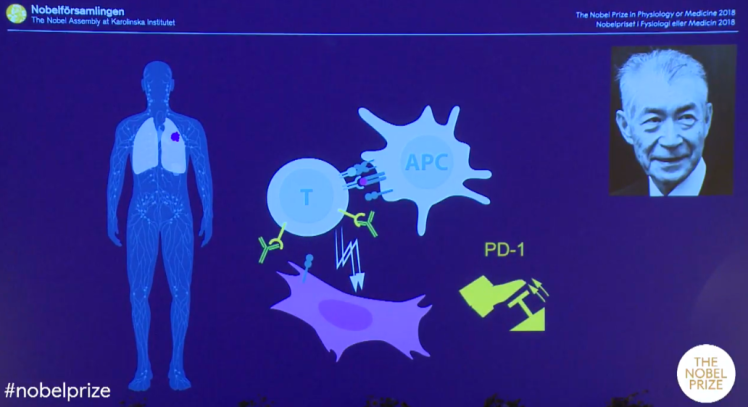
Honjo da, yine bir T-hücresi freni olarak da çalışan, ancak CTLA-4’ten farklı bir moleküler mekanizma yoluyla bu işi yapan PD-1’i (programlı hücre ölümü-1) keşfetti. Kyoto Üniversitesi’nde Tasuko Honjo ve ekibi, hücrelerin programlanmış hücre ölümünü (apoptoz) çalışırken, programlanmış hücre ölümü-1 (PD-1) reseptörünü tanımladı. Bu yeni reseptöre iki çeşit ligandn bağladığı belirlendi: PD-L1 ve PD-L2 (Programlı hücre ölümü yolağı ligandları-1 ve 2). Çeşitli otoimmün hastalıklarda ve tümör hücrelerinin yüzeyinde yüksek düzeyde PD-L1 ve 2 bulunuyordu. Dolayısı ile PD-1 resptörünü bloke etmek işe yarayabilirdi. Honjo bunu potansiyel bir insan kanseri tedavisi olarak ileri sürdürdü ve bugün kliniğe ulaşan adına Nivolumab (ticari adı Opdivo) denen antikor tedavisi geliştirildi.
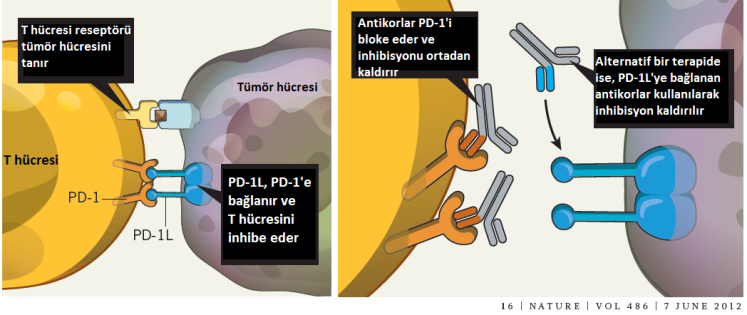
Bu protein de yine T hücrelerinin yüzeyinde ifade ediliyordu. Anti-PD-1 “kontrol noktası inhibitörleri”nden öne çıkan Nivolumab ve Pembrolizumab (ticari adı Keytruda) ile yapılan tedavinin akciğer ve böbrek kanserinin yanı sıra, lenfoma ve melanom hastalarına anti-CTLA-4 tedavisinden daha etkili olduğunu gösterdi.

Devam eden araştırmalar gösterdi ki, hem CTLA-4’ü hem de PD-1’i hedef alan kombinasyon tedavileri daha etkili olabilmekte…
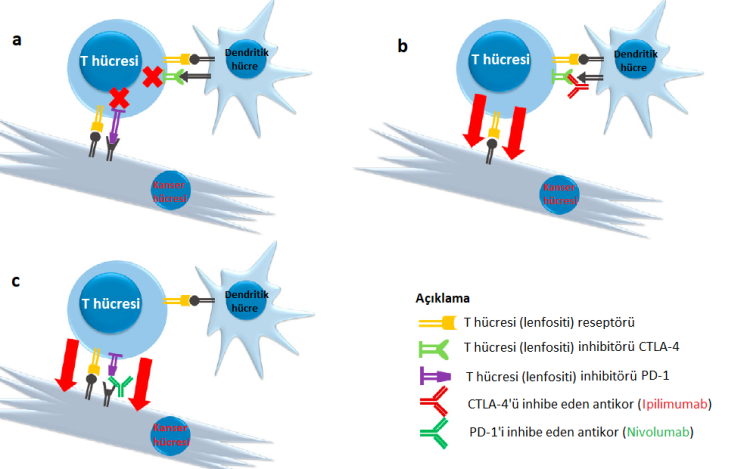
Şekil: a) İnhibe edici PD-1 ve CTLA-4 reseptörleri üzerinden gelen sinyal sitotoksik T lenfosit aktivitesini azaltarak onların kanser hücrelerini öldürme fonksiyonlarını bozar. b) CTLA-4 reseptörünün Ipilimumab antikoru kullanılarak bloke edilmesi, T lenfositini inhibe edici kontrolden serbest bırakarak kanser hücrelerine saldırmasına izin verir. c) PD-1 reseptörüne müdahale, T lenfositlerin hedefini (kanser hücresini) öldürme kabiliyetini artırabilir.
Honjo ve Allison’ın çalışmalarının sonuçları, malign melanomalı hastaların tedavisinde kombine halde kullanıldı. Bazı tümörlerin Ipilimumab antikoruna kayda değer tepkisi, bunun bir ilaç bloke edici PD-1 ile birleştirilmesine ilgi duymasına neden olmuş, bu nedenle kombinasyon immünoterapisinde Ipilimumab ve Nivolumabkullanımı ile ilgili deneyler oluşturulmuştur. 2013 yılında başlatılan CheckMate 067 çalışması daha önce tedavi edilmemiş metastatik melanomalı 945 hasta üzerinde yapıldı. İlaçlardan ikisini birden alan kombinasyon tedavide 4 yıllık sağkalım % 51 idi. Sonuçlar, kanserleri kombinasyon immünoterapileri ile tedavi etmenin mümkün olduğu ve çok etkili olabileceğine dair kanıtlar sağladı. Bununla birlikte, bu tedavilerin önemli otoimmün benzeri yan etkilerin olabileceğini de ortaya koydu. Kombinasyon immünoterapi ile tedavi edilen çoğu kişi, bu yan etkileri (örn. iltihaplı bağırsak hastalığına benzer şekilde ciddi ishal ve bağırsak iltihabı) yaşar ve bunların yarısından fazlası hastanede tedaviyi gerektirecek kadar ağırdır ve hastalar genellikle uzun süre steroid tedavisi ve bazen de diğer immün baskılayıcı ve hatta ameliyatlar gerektirir. Yan etkiler arasında, akciğerlerde hasar, cilt, tiroid ve hipofiz bezi gibi hormon üreten bezlerin bile tahribi görülür. Bu nedenle, tüm bireylerin immünoterapiye anlamlı bir cevap vermeyeceğini hatırlamak önemlidir. Malign melanom nadir görülen immünojenik bir kanserdir ve melanomlu bazı hastalarda gözlenen dramatik pozitif sonuçlar diğer kanserlerde çok daha az görülür. Kontrol noktası inhibitörleri küçük hücreli akciğer kanseri, baş ve boynun skuamöz hücre kanserleri, böbrek ve mesane kanserinin yanı sıra Hodgkin lenfoması için kullanım lisansları almıştır. Bununla birlikte, çok sayıda yaygın kanserin bu startezi ile tadavi edeilemeiyeceği ve farklı stratejilere ihtiyaç olduğunu göstermiştir.
İmmünoterapilere bazen yaygın olarak “kanser aşısı” adı da verilmektedir. 2011 yılında FDA, melanom tedavisi için başka bir ilaç olan Ipilimumab (Yervoy) ‘ı onayladı. Yervoy (ipilimumab) bir sentetik antikor (monoklonal antikor) olup, normalde T-hücresi aktivasyonunu önleyerek immün sistemde bir fren görevi gören CTLA-4 (sitotoksik T lenfosit ilişkili antijen-4) adlı bir “kontrol noktası” proteinine bağlanır ve bunu bloke eder. Kontrol noktası proteinleri hücreleri normal dokuya saldırmadan kontrol altında tutar. Yervoy freni serbest bıraktığında, T hücreleri tümörleri yok etmekte artık özgürdür! Yani bu ilaç sitotoksik T-lenfosit antijeni 4’ü (CTLA-4) hedefler ve aynen PD-1’de olduğu gibi, CTLA-4 de T hücrelerinin saldırısını durdurmak için tümör hücreleri tarafından kullanılır. Ancak, CTLA-4 bağlanması, T hücreleri ile vücuttaki diğer normal hücreler arasında da meydana gelebilirken, PD-1 bağlanma sadece tümör hücreleri tarafından olur. Dolayısı ile CTLA-4’ün aksine, PD-1 doğrudan kanser hücreleri ile etkileşime girer ve bu nedenle PD-1 inhibitörleri daha güçlü ve daha az toksik olma potansiyeline sahiptir.
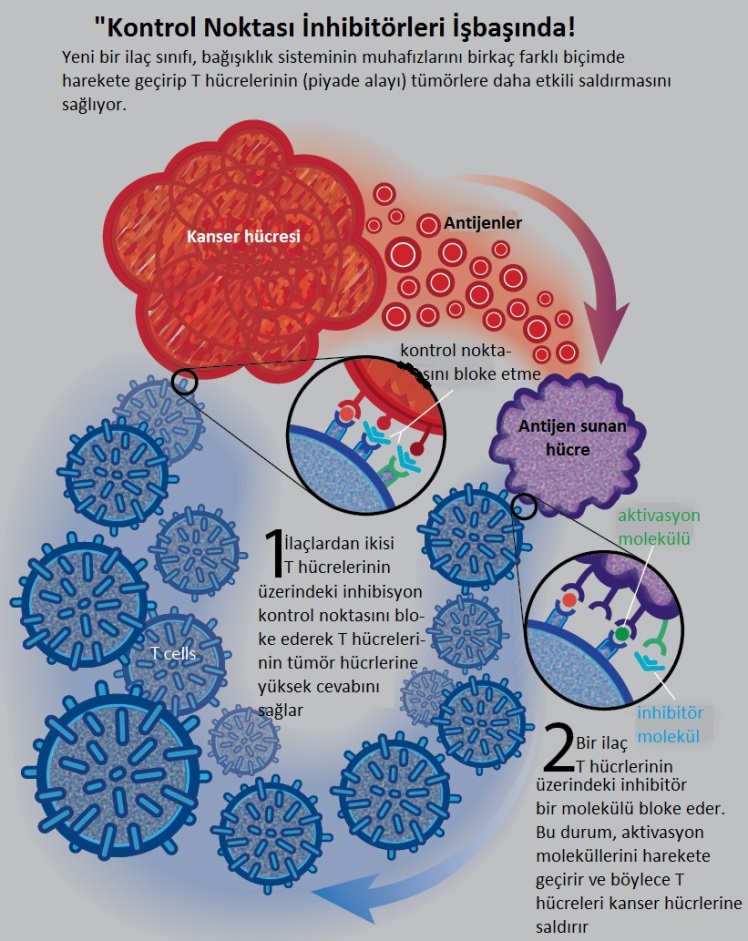
Her iki kanser immünoterapisinin (kanser aşısının) tüm bu iyiliğine karşın, hastaların ancak küçük bir yüzdesinde çalışması bu uygulamaların kötü tarafını oluşturuyor. Örneğin, melanom hastalarının sadece %10’unda ipilimumab etkili olurken, PD-1’a karşı yapılan tedavide bu oran %30’u bulmuş. İşin garip tarafı, bu anti-PD-1 teadvisinin akciğer kanserinde de neredeyse %30 ekili olduğunun görülmesi olmuş. Fakat, hastaların %10’unda her iki tedavi şekli de ölümcül yan etkiler de göstermişler. Şimdilerde, bu yan etkilerin nasıl ortaya çıktığı ve muhtemel önlemlerin neler olabileceği araştırılıyor.
Kanser kemoterapisi ile kombine kullanıldığında oldukça etkili bir terapi sağlayan inetrlökin-2 (IL-2) gibi, Yervoy da uzun süreli (10 yıl kadar) tedavi sağlayabilir. Ancak bu klinik tedaviler hastaların sadece küçük bir kısmında (yaklaşık % 8’inde) mümkün olabiliyor. Kötü yanı ise, hastaların % 15’lik gibi önemli bir kısmında Yeryov’un normal dokulara da saldırması! Ve hatta bazılarında ölüme sebep olması!!!
Ancak, olum/olumsuzluklara rağmen “kontrol noktası inhibitörlerinin” kanser immünoterapisindeki potansiyeli olacak gibi. Örneğin, bazı araştırmalar bazı kanserlerde tümörü çevreleyen T hücrelerinin devre dışı bırakılmasının nedeni olan bir kontrol noktası proteini PD-1’e (Programlı hücre ölümü yolağı-1) odaklanmaya başlamıştır. CTLA-4’ün aksine PD-1, doğrudan kanser hücreleri ile etkileşime girdiğinden, bunun inhibitörleri daha güçlü ve daha az toksik olma potansiyeline sahiptir ve klinik çalışmalar bunun böyle olduğunu göstermektedir. Önde gelen bir PD-1 inhibitörü Nivolumab olup, ilerleyen melanoması olan kişilerin% 28’inde tümörleri küçülttüğü görülmüştür. İnsan monoklonal antikor üretimi için genetik modifikasyonları kullanan ve bunun için 2018 Nobel Kimya Ödülü’nü alan Sir Greg Winter antikor gelişimi ve evrimi konusunda çalışmaktadır. Laboratuvarda üretilen bu moleküller, belirli bir hedefe bağlanmak için büyük miktarlarda üretilebilir. 1997 yılında, Rituximab insanlarda kullanımı onaylanan ilk anti-kanser antikor oldu. Bu, giderek yaygınlaşan bir kanser olan Hodgkin olmayan lenfomalı hastalarda sağ-kalımda belirgin bir iyileşme ile sonuçlandı. Bunu, hızlı bir şekilde meme kanseri için Trastuzumab ve daha sonra göreceğimiz gibi kontrol noktası inhibitörleri dahil olmak üzere bir dizi başka monoklonal antikor terapisinin gelişmesi izledi.
Sonuç olarak…
Allison ve Honjo’nun çalışması, kanser immünoterapisinin geniş çapta yayılması için bir kanıt sağladı ve bu alanda yeni bir coşku uyandırdı. Günümüzde, bir dizi yeni kontrol noktası inhibitörü klinik aşamadadır ve birçok farklı ortamda denenmektedir. Bunlar, metastatik hastalık için ve kemoterapi, radyoterapi ve hedefe yönelik ajanlarla kombinasyon halinde adjuvan terapiyi içerir. Antikanser immün tepkisini arttırmanın diğer yöntemleri de araştırılmaktadır. “Adoptif hücre tedavisi” tekniği, Amerikan Ulusal Kanser Enstitüsünde geliştirilmiştir. Bu teknikte, bir hastanın tümör numunesinden T lenfositleri toplanır. Bu hücreler daha sonra çoğaltılarak hastaya yüksek miktarlarda verilerek inhibe edici bağışıklık mekanizmanın üstesinden gelmesi beklenir.
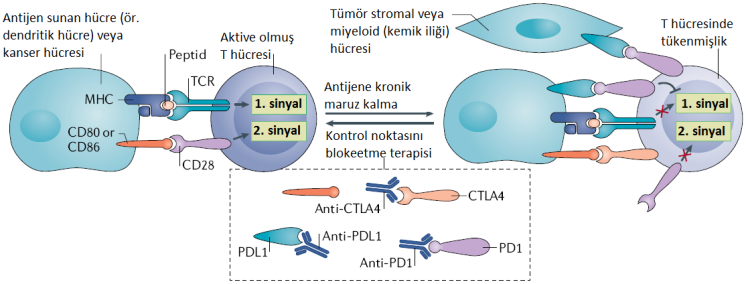
Şekil: T hücreleri, yüzey reseptörleri ile peptid antijenleri tanır, bağlanır ve aktif hale gelirler. T hücresi aktivasyonu için iki sinyal gereklidir. Birinci sinyal büyük doku-uyumluluk kompleksi (MHC) tarafından sunulan immünojenik peptid antijeninin heterodimerik (iki farklı alt üniteden oluşan) T hücre reseptörüne (TCR) bağlanması sonucu oluşur. Aynı zamanda ortak uyarım olarak da adlandırılan ikinci sinyal, T hücresinin bağlanması yoluyla iletilir. Aktive edildiğinde, T hücreleri yüzeylerinde sitotoksik T lenfosit antijeni 4 (CTL A4) respetörü ve programlanmış hücre ölümü 1 (PD1) reseptörü gibi reseptörler ifade etmeye başlar. CD80 veya CD86 ile CTLA-4’ün bağlanması uyarımı engeller (sinyal 2) ve T hücresi aktivasyonunun devam etmesini önler. CTLA-4 ile CD80 veya CTLA-4 ile CD86 etkileşiminin engellenmesi lenfoid organlarda T hücrelerinin aktivasyonunu teşvik eder. PD1’in ligandına yani PDL1’e bağlanması, TCR’ın akış aşağı yönünde sinyalini inhibe eder ve böylece birinci sinyal bloke edilir. PDL1, tümörlerde ve tümör çevresinde sıklıkla ifade edilir. Bu nedenle, PD1 hedefli veya PDL1 hedefli antikor terapötikleri, bitkin (tükenmiş) T hücrelerini tümörlere karşı yeniden canlandırabilir.
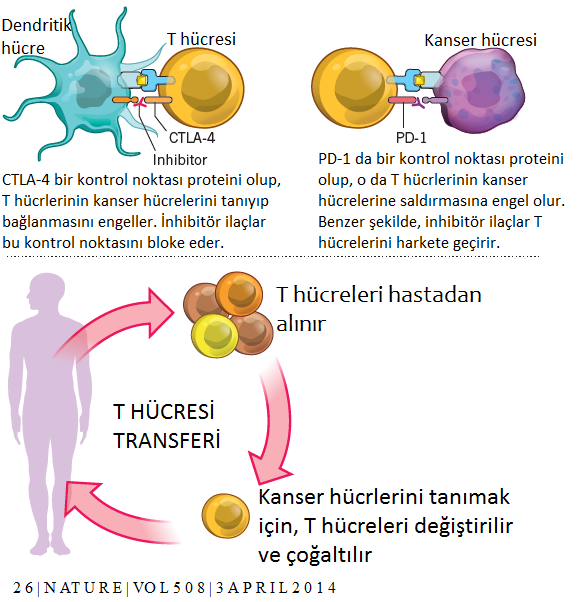
Bu yöntemin daha da ileri aşaması, bir hastanın T lenfositlerinin periferik kandan toplanması ve tümöre spesifik hücre yüzeyi belirteçleri (yeni hücre yüzey reseptörleri ilavesi) ile donatılması idi. Bu çeşit T mühendisliğine dyanan tedavi “kimerik antijen reseptörü tedavisi (CAR-T) olarak bilinir. Bu tedaviye ileri evre lenfoma veya lösemili hastalar tam ve kalıcı tepkiler verebilirler. Bununla birlikte, yan etkiler ve tedavi maliyeti en negatif unsurlardır ve ayrıca şu anda bu teknolojinin, yalnızca sınırlı sayıda hematolojik (kan) kansere karşı etkili olduğu kanıtlanmıştır.
Kaynaklar
- The Killer Within, 24 | NATURE | VOL 508 | 3 APRIL 2014
- The evolving landscape of biomarkers for checkpoint inhibitor immunotherapy. NATURE REVIEWS | CANCER volume 19 | MARCH 2019
- The CAR T Cell Revolution, Cell, 2016
- Frontiers in Immuno-Oncology 1 and 2. Cell Press Selections 2017
- The Biochemist, Immunology, February 2019


 Harvard Üniversitesi bu yıl büyük davalarla boğuşuyor. Sebebi, öğrenci alımlarında yanlı davranıldığının düşünülmesi. Özellikle uzak Asyalı öğrenciler mükemmel skorlara rağmen Harvard’a alınmadıklarını, buna karşın kendilerinde daha düşük notlara sahip beyaz Amerikalılara torpil geçildiğini iddia etmekte ve dolayısı ile öğrencilerin kendileri veya dernekler tarafından Harvard’a davalar açılmaktadır.
Harvard Üniversitesi bu yıl büyük davalarla boğuşuyor. Sebebi, öğrenci alımlarında yanlı davranıldığının düşünülmesi. Özellikle uzak Asyalı öğrenciler mükemmel skorlara rağmen Harvard’a alınmadıklarını, buna karşın kendilerinde daha düşük notlara sahip beyaz Amerikalılara torpil geçildiğini iddia etmekte ve dolayısı ile öğrencilerin kendileri veya dernekler tarafından Harvard’a davalar açılmaktadır.