 Bağışıklık sistemi, çeşitli farklı hücre tiplerinden ve proteinlerden oluşur. Her öğe, yabancı maddeyi tanımayı ve ona tepki vermeyi amaçlayan belirli bir görevi yerine getirir.
Bağışıklık sistemi, çeşitli farklı hücre tiplerinden ve proteinlerden oluşur. Her öğe, yabancı maddeyi tanımayı ve ona tepki vermeyi amaçlayan belirli bir görevi yerine getirir.
Bağışıklık Sisteminin Organizasyonu ve Gelişimi
Bağışıklık sistemi, enfeksiyona karşı birlikte çalışan hücre ve proteinler arasında mükemmelbir işbirliğidir. Bu hücreler ve proteinler, kalp veya karaciğer gibi tek bir organ oluşturmazlar. Bunun yerine, bağışıklık sistemi enfeksiyona hızlı yanıt vermek için vücudun her yerinde bulunur (Şekil). Hücreler kan dolaşımında veya lenfatik adı verilen özel damarlar içinde hareket eder. Lenf düğümleri ve dalak, hücreden hücreye iletişimi kolaylaştıran yapılar sağlar.
Bağışıklık sisteminin iki hücresi (sırasıyla B hücreleri ve T hücreleri) sırası ile kemik iliği (bone marrow) ve timus‘ta eğitilirler. Bağışıklık sisteminin tüm hücrelerinin gelişimi, kemik iliğinde hematopoietik (kan oluşturan) kök hücreler ile başlar (Şekil). Bunlara “kök” hücre denmesinin sebebi, diğer tüm özelleşmiş hücrelerin ondan doğmasıdır. Tam bir bağışıklık sistemi oluşturma kabiliyeti nedeniyle, bunlar bir kemik iliği veya hematopoietik kök hücre naklinde en önemli hücrelerdir. Embriyonik kök hücrelerle ilgili olsalar da, bunlar farklı bir hücre tipidir. Çoğu durumda, bir hücre tipinin gelişimi diğer hücre tiplerinden bağımsızdır.
İmmün yetmezlikler, bağışıklık sisteminin yalnızca tek bir bileşenini veya birden fazla hücre ve proteini etkileyebilir.
Bağışıklık sisteminin tüm bileşenleri birbiriyle etkileşim halinde olsa da, genellikle iki geniş bağışıklık tepkisi göz önünde bulundurulur: doğuştan gelen bağışıklık sistemi ve uyarlanabilir bağışıklık sistemi.
Doğuştan gelen bağışıklık tepkileri, “eğitim” gerektirmeyen hücrelerle olur. Bu hücreler arasında nötrofiller, monositler, doğal öldürücü (NK) hücreler ve tamamlayıcı (kompleman) proteinler olarak adlandırılan bir dizi protein bulunur. Enfeksiyona karşı doğuştan gelen tepkiler hızlı ve güvenilir bir şekilde gerçekleşir. Bebeklerin bile mükemmel doğuştan bağışıklık tepkileri vardır.
Uyarlanabilir bağışıklık tepkileri ikinci kategoriyi oluşturur. Bu tepkiler, kendi hücrelerimize saldırmamayı öğrenmek için “eğitim” gerektiren iki hücre türü içerir: T hücreleri ve B hücreleri. Uyarlanabilir yanıtların avantajları, uzun ömürlü bellekleri ve yeni mikroplara uyum sağlama becerileridir.
Her iki bağışıklık tepkisi kategorisinin merkezinde, yabancı istilacıları kendi dokularımızdan ayırt etme yeteneği vardır. Hızlı yanıt verme yeteneklerinden dolayı, doğuştan gelen tepkiler genellikle bir “istilaya” ilk yanıt verir. Bu ilk yanıt, tamamen etkinleştirilmesi birkaç gün sürebilen uyarlanabilir yanıtı uyarır ve tetikler.
Yaşamın erken dönemlerinde doğuştan gelen tepkiler en belirgindir. Yeni doğan bebekler annelerinden antikor alırlar ancak birkaç hafta boyunca kendi antikorlarını üretmezler.
Uyarlanabilir bağışıklık sistemi doğumda işlevseldir, ancak optimal hafıza tepkileri için gerekli deneyimi kazanmamıştır. Bu hafıza oluşumu yaşam boyunca meydana gelse de, immünolojik deneyimdeki en hızlı kazanç doğum ile üç yaş arasındadır. Her bulaşıcı maruziyet, hücrelerin eğitimine yol açar, böylece aynı enfeksiyona ikinci bir maruziyete yanıt, daha hızlı ve daha büyüktür.
Yaşamın ilk birkaç yılında, çoğu çocuk çok çeşitli enfeksiyonlara yakalanır ve bu spesifik enfeksiyonlara yönelik antikorlar üretir. Antikoru üreten hücreler enfeksiyonu “hatırlar” ve ona uzun süreli bağışıklık sağlar. Benzer şekilde, T hücreleri vücudun karşılaştığı virüsleri hatırlayabilir ve aynı virüsle tekrar karşılaştıklarında daha güçlü bir tepki verebilir. Erken çocuklukta adaptif bağışıklık sisteminin bu hızlı olgunlaşması, yaşla birlikte neyin normal olduğuna dair beklentiler değiştiği için küçük çocukları test etmeyi zorlaştırır. Uyarlanabilir bağışıklık sisteminin aksine, doğuştan gelen bağışıklık sistemi doğumda büyük ölçüde sağlamdır.
Bağışıklık Sisteminin Ana Organları
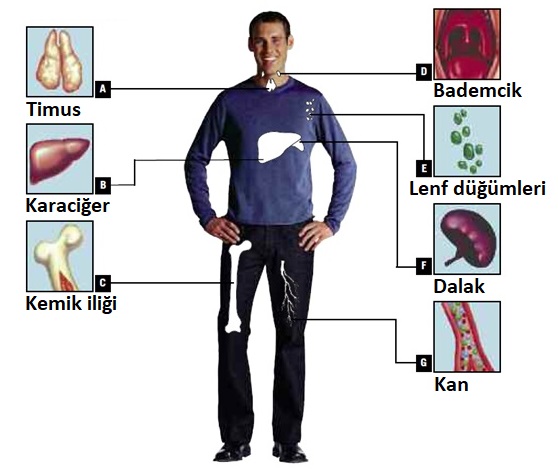
A. Timus: Timus göğsün üst kısmında bulunan bir organdır. Olgunlaşmamış lenfositler kemik iliğini terk eder ve olgun T lenfositleri olmak üzere “eğitildikleri” timusa giden yolu bulur.
B. Karaciğer: Karaciğer , tamamlayıcı (kompleman) sistemin proteinlerini sentezlemekten sorumlu ana organdır. Ek olarak, kan dolaşımı ile gelen bakterileri yutan çok sayıda fagositik hücre içerir.
C. Kemik İliği: Kemik iliği, bağışıklık sisteminin tüm hücrelerinin primitif (farklılaşmamış) kök hücrelerden gelişmeye başladığı yerdir.
D. Bademcikler: Bademcikler boğazdaki lenfositlerin bir birikmesidir.
E. Lenf Düğümleri: Lenf düğümleri, vücuttaki B lenfositleri ve T lenfositlerin birer koleksiyonudur. Hücreler birbirleriyle iletişim kurmak için lenf düğümlerinde bir araya gelir.
F. Dalak: Dalak, T lenfositleri, B lenfositleri ve monositlerin bir koleksiyonudur. Kanı filtrelemeye yarar ve bağışıklık sistemindeki organizmalar ve hücrelerin etkileşime girmesi için bir alan sağlar.
G. Kan: Kan, bağışıklık sisteminin hücrelerini ve proteinlerini vücudun bir bölümünden diğerine taşıyan dolaşım sistemidir.
Bağışıklık Sisteminin Hücreleri

- Bağışıklık hücreleri
A. Kemik iliği: Vücuttaki bağışıklık sistemindeki hücrelerin çoğunun olgunlaşmamış veya kök hücreler olarak üretildiği bölge.
B. Kök hücreler: Bu hücreler, bağışıklık sisteminin farklı hücrelerine farklılaşma ve olgunlaşma potansiyeline sahiptir.
C. Timus: Göğüste bulunan ve olgunlaşmamış lenfositlere olgun T lenfositlere dönüşme talimatı veren bir organdır.
D. B-Hücreleri: Bu lenfositler kemik iliğinde ortaya çıkar ve plazma hücrelerine dönüşerek immünoglobülinleri (antikorlar) üretir.
E. Sitotoksik T hücreleri: Bu lenfositler timusta olgunlaşır ve enfekte olmuş hücrelerin öldürülmesinden sorumludur.
F. Yardımcı T hücreleri: Bu özelleşmiş lenfositler, işlevlerini yerine getirmeleri için diğer T hücrelerine ve B hücrelerine “yardımcı olur”.
G. Plazma Hücreleri: B hücrelerinden gelişen bu hücreler, serum ve sekresyonlar için immünoglobulin yapan hücrelerdir.
H. İmmünoglobulinler: Antikor olarak da bilinen bu oldukça özelleşmiş protein molekülleri, çocuk felci gibi yabancı antijenlere kilit ve anahtar gibi uyar. Çeşitleri o kadar geniştir ki çevremizdeki tüm olası mikroorganizmalara uyacak şekilde üretilebilirler.
I. Nötrofiller (Polimorfonükleer PMN Hücresi): Kanda bulunan ve mikroorganizmaları hızla yutan ve öldüren bir hücre türüdür.
J. Monositler: Kan dolaşımında bulunan ve dokulara göç ettiğinde bir makrofaja dönüşen bir tür fagositik hücre.
K. Kırmızı Kan Hücreleri: Akciğerlerden dokulara oksijen taşıyan kan dolaşımındaki hücreler.
L. Trombositler: Kan dolaşımında bulunan ve kanın pıhtılaşmasında önemli olan küçük hücreler.
M. Dendritik Hücreler: Bağışıklık sistemi hücrelerine antijenin sunulmasında önemli hücreler.
Bağışıklık Sisteminin Bileşenleri
Bağışıklık sisteminin hücreleri, lenfositler (T hücreleri, B hücreleri ve NK hücreleri), nötrofiller ve monositler / makrofajlar olarak kategorize edilebilir. Bunların hepsi beyaz kan hücreleridir. Bağışıklık sisteminin ana proteinleri ağırlıklı olarak sinyal proteinleri (sitokinler), antikorlar ve tamamlayıcı (kompleman) proteinlerdir.
Bağışıklık Sisteminin Lenfositleri
B Hücreleri
B hücreleri (bazen B lenfositler olarak adlandırılır ve genellikle laboratuvar raporlarında CD19 veya CD20 hücreleri olarak adlandırılırlar), ana işlevi antikor (ayrıca immünoglobülinler veya gama globülinler olarak da adlandırılırlar) üretmek olan bağışıklık sisteminin özel hücreleridir. B hücreleri, kemik iliğinde hematopoietik kök hücrelerinden gelişir. Kemik iliğinde olgunlaşırlarken, B hücreleri kendi sağlıklı dokularımıza karşı antikor üretmemeleri için eğitilirler. Olgunlaşan B hücreleri kemik iliğinde, lenf düğümlerinde, dalakta, bağırsağın bazı bölgelerinde ve kan dolaşımında bulunabilirler.

- B hücreleri (Prof. Dr. Mustafa Özdoğan’ın izniyle… Link..)
B hücreleri yabancı maddelerle (antijenler) karşılaştığında, plazma hücreleri adı verilen başka bir hücre tipine olgunlaşarak yanıt verirler. B hücreleri aynı zamanda, aynı enfeksiyonla tekrar karşılaşıldığında hızlı bir tepkiye izin veren hafıza hücrelerine de olgunlaşabilir. Plazma hücreleri, antikorları bol miktarlarda üreten olgun hücrelerdir. Plazma hücrelerinin ana ürünü olan antikorlar, kan dolaşımına, dokulara, solunum salgılarına, bağırsak salgılarına ve hatta gözyaşlarına girerler. Antikorlar, oldukça özelleşmiş serum protein molekülleridir.
Her yabancı antijen için, kilit ve anahtar gibi o antijene uyacak şekilde özel olarak tasarlanmış antikor molekülleri vardır. Örneğin, poliovirüse (çocuk felci virüsü), difteriye ve kızamık virüsüne fiziksel olarak uyan antikor molekülleri vardır. B hücreleri, çevremizdeki neredeyse tüm mikroplara karşı sayısısız çeşitte farklı antikor molekülleri üretirler. Bununla birlikte, her plazma hücresi yalnızca bir tür antikor üretir.
Antikor molekülleri bir mikroorganizmayı yabancı olarak algıladığında, ona fiziksel olarak bağlanır ve sonunda mikropu yok etmeye çalışan bağışıklık sisteminin diğer bileşenlerini de içeren karmaşık bir olaylar zincirini başlatırlar. Antikorlar, vücuttaki özel işlevlerine göre değişir. Bu varyasyonlar, antikorun kimyasal yapısı tarafından belirlenir ve bu da antikorun (veya immünoglobülin) sınıfını belirler.
Beş ana antikor sınıfı vardır (IgG, IgA, IgM, IgD ve IgE). IgG’nin dört farklı alt sınıfı vardır (IgG1, IgG2, IgG3, IgG4). IgA’nın iki alt sınıfı vardır (IgA1 ve IgA2).
Her bir immünoglobulin sınıfı, kendisine belirli işlevler sağlayan farklı kimyasal özelliklere sahiptir (Şekil). Örneğin IgG antikorları büyük miktarlarda oluşur, birkaç hafta dolaşımda kalır ve kan dolaşımından dokulara kolayca ulaşır. Yalnızca IgG plasentayı geçer ve anneden yenidoğana bir miktar bağışıklık aktarır.
IgA sınıfı antikorlar, mukus zarlarının yakınında üretilir ve solunum yolu ve bağırsaklardaki enfeksiyona karşı koruma sağladıkları gözyaşı, safra, tükürük ve mukus gibi salgılara girerler. IgA’nın bir kısmı dolaşımda da görülür.
IgM sınıfı antikorlar, enfeksiyona yanıt olarak oluşan ilk antikorlardır. Bir enfeksiyonun ilk günlerinde korunmada önemlidirler.
IgE sınıfının antikorları, alerjik reaksiyonlardan sorumludur.
Antikorlar, vücudu enfeksiyona karşı birkaç farklı yolla korur. Örneğin, virüsler gibi bazı mikroorganizmalar, bir enfeksiyona neden olmadan önce vücut hücrelerine bağlanmalıdır, ancak bir virüsün yüzeyine bağlanan antikorlar, virüsün konakçı hücreye bağlanma kabiliyetine müdahale edebilir. Ayrıca bazı mikroorganizmaların yüzeyine bağlanan antikorlar, bazı bakteri veya virüsleri doğrudan öldürebilen tamamlayıcı (kompleman) sistem adı verilen bir grup proteinin aktivasyonuna neden olabilir.
Antikor kaplı bakteriler, nötrofillerin yutması ve öldürmesi için antikorlarla kaplı olmayan bakterilere göre çok daha kolaydır. Antikorların tüm bu etkileri, mikroorganizmaların vücut dokularını başarılı bir şekilde istila etmesini ve ciddi enfeksiyonlara neden olmasını engeller.
Plazma hücreleri uzun ömrü olup, yıllar önce bizi enfekte eden virüslere ve bakterilere karşı bağışıklığımızı korumamızı sağlar. Örneğin, insanlar kızamık virüsünün canlı aşı suşları ile tam olarak aşılanmış olduklarında, plazma hücrelerini ve antikorları yıllarca tuttukları ve bu antikorlar enfeksiyonu önledikleri için neredeyse hiçbir zaman artık kızamığa yakalanmazlar.
T Hücreleri
T hücreleri (bazen T lenfositler ve bilimsel raporlarda genellikle CD3 hücreleri olarak adlandırılır) başka bir bağışıklık hücresi türüdür. T hücreleri, virüslerle enfekte olan hücrelere doğrudan saldırır ve ayrıca bağışıklık sisteminin düzenleyicileri olarak hareket ederler.
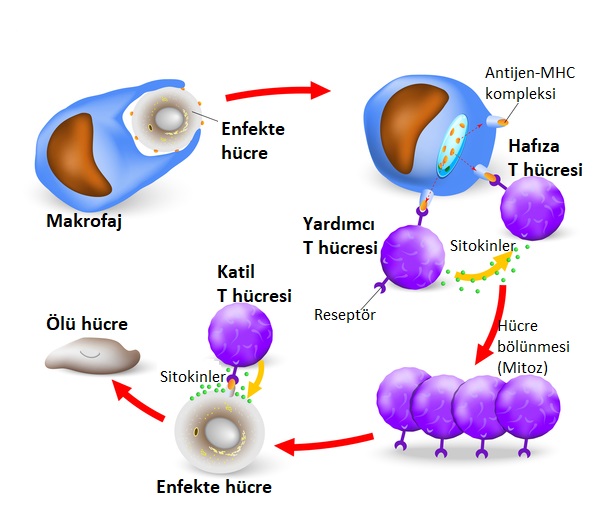
T hücreleri, kemik iliğindeki hematopoetik kök hücrelerden üretilir, ancak gelişimlerini timusta tamamlarlar. Timus, göğüste bağışıklık sisteminin papyon (kelebek) seklinde olan özel bir organıdır. Timus içinde, olgunlaşmamış lenfositler olgun T hücrelerine (“T” timus anlamına gelir) dönüşür ve normal dokularımıza saldırma potansiyeline sahip T hücreleri ortadan kaldırılır. Timus bu süreç için çok önemlidir ve fetüste timüs yoksa T hücreleri gelişemez. Olgun T hücreleri timustan ayrılır ve dalak, lenf düğümleri, kemik iliği ve kan gibi bağışıklık sisteminin diğer organlarını doldurur.
Bir antikor molekülünün belirli bir antijenle reaksiyona girmesi gibi, her bir T hücresi belirli bir antijenle reaksiyona girer. Aslında, T hücrelerinin yüzeylerinde antikorlara benzer moleküller bulunur. Farklı T hücrelerinin çeşitliliği o kadar geniştir ki, vücut neredeyse tüm antijenlere karşı tepki verebilen T hücrelerine sahiptir.
T hücreleri, antijeni tanımak için farklı yeteneklere sahiptir ve işlevlerinde çeşitlilik gösterir. “Katil” veya sitotoksik T hücreleri (genellikle CD8 T hücreleri olarak bilinirler), yardımcı T hücreleri (genellikle CD4 T hücreleri olarak bilinirler) ve düzenleyici T hücreleri vardır. Her birinin bağışıklık sisteminde farklı bir rolü vardır.
Katil veya sitotoksik T hücreleri, enfekte olmuş hücrelerin gerçek imhasını gerçekleştirir. Katil T hücreleri, bizi hücrelerimize giren ve orada çoğalabilen belirli bakteri ve virüslerden korur. Katil T hücreleri, böbrek nakli gibi vücuttaki yabancı doku ve organlara da yanıt verir. Bunun için, katil hücreler enfeksiyon bölgesine göç etmeli ve yabancı ajanın yok edilmesini sağlamak için doğrudan hedefine bağlanmalıdır.
Adından da anlaşılacağı üzere yardımcı T hücreleri, B hücrelerinin antikor üretmesine ve yabancı maddelere saldırılarında öldürücü T hücrelerine yardımcı olurlar.
Düzenleyici T hücreleri, diğer T lenfositlerini baskılar veya işlevsizleştirir. Düzenleyici hücreler olmadan, enfeksiyon tedavi edildse bile bağışıklık sistemi çalışmaya devam eder ki bu istenmeyen bir durumdur. Düzenleyici T hücreleri olmadan, vücudun enfeksiyona “aşırı tepki verme” potansiyeli vardır. Düzenleyici T hücreleri, lenfosit sisteminin termostatı gibi görev görür ve onu yeterince açık tutar (ne çok fazla ne de çok az).
İmmünoglobulin Yapısı

Her bir immünoglobulin sınıfı veya türü, diğerleriyle ortak özellikleri paylaşır. Hepsinde, spesifik olarak yabancı antijen ile birleşen antijen bağlama bölgeleri vardır.
A. IgG: IgG vücuttaki başlıca immünoglobülin sınıfıdır ve dokularda olduğu kadar kan dolaşımında da bulunur.
B. Salgılayıcı IgA: Salgı IgA, bir J-zinciri ile birleştirilmiş ve bir salgı parçasına bağlanmış iki IgA molekülünden oluşur. Bu modifikasyonlar, salgı IgA’nın mukus, bağırsak sıvıları ve gözyaşlarına salgılanmasına izin verir ve bu alanları enfeksiyondan korur.
C. IgM: IgM, birbirine bağlı beş immünoglobulin molekülünden oluşur. Enfeksiyonda çok erken oluşur ve tamamlayıcıyı (kopleman) çok kolay aktive eder.
NK Hücreleri
Doğal öldürücü (NK) hücreler, virüslerle enfekte olan hücreleri kolayca öldürdükleri için bu şekilde adlandırılırlar. T hücrelerinin gerektirdiği “timik eğitimi” gerektirmedikleri için “doğal katil” hücreler oldukları söylenir. NK hücreleri kemik iliğinden türetilir ve kan dolaşımında ve dokularda nispeten düşük sayılarda bulunurlar. Virüslere karşı savunmada ve muhtemelen kanseri önlemede de önemlidirler.
NK hücreleri, virüs bulaşmış hücrelere öldürücü bir kimyasal iksir enjekte ederek öldürürler. Herpes virüslerine karşı savunmada özellikle önemlidirler. Bu virüs ailesi, herpesin geleneksel uçuk formunu (herpes simpleks), Epstein-Barr virüsünü (bulaşıcı mononükleozun nedeni) ve suçiçeği virüsünü içerir.
Nötrofiller
Nötrofiller veya polimorfonükleer lökositler (PMN’ler), tüm beyaz kan hücresi türlerinin en çok sayıda bulunanlarıdır. Tüm beyaz kan hücrelerinin yaklaşık yarısını veya daha fazlasını oluştururlar. Aynı zamanda granülositler olarak da adlandırılırlar ve tam kan sayımının bir parçası olarak laboratuvar raporlarında ifade edilirler (diferansiyel CBC). Kan dolaşımında bulunurlar ve birkaç dakika içinde enfeksiyon bölgelerine geçebilirler. Bu hücreler, bağışıklık sistemindeki diğer hücreler gibi, kemik iliğindeki hematopoetik kök hücrelerden gelişirler.
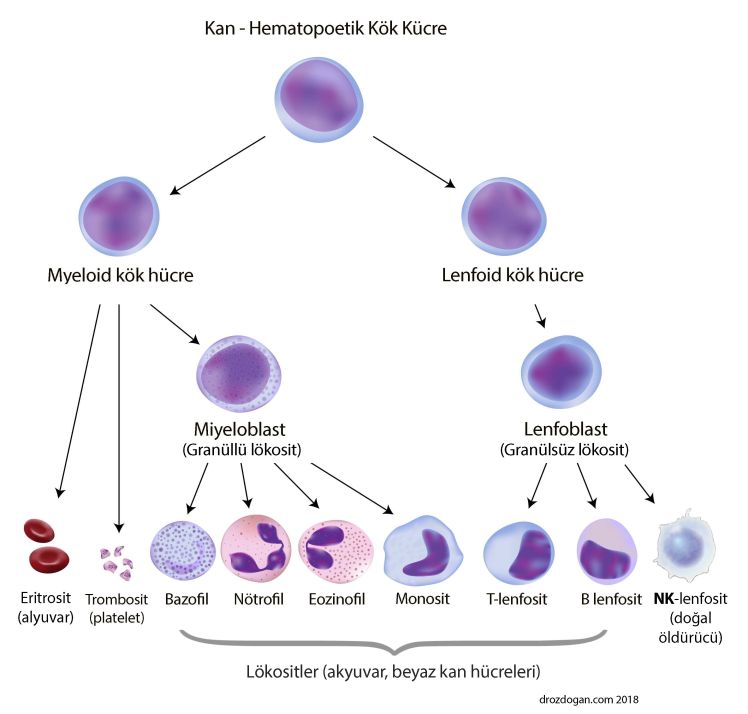
- Hematopoetik (değişik kan hücrlerine dönüşen) kök hücreler (Prof. Dr. Mustafa Özdoğan’ın izniyle… Link..)
Enfeksiyon sırasında kan dolaşımındaki nötrofil sayısı artar ve bazı enfeksiyonlarda görülen yüksek beyaz kan hücresi sayısını ifade ederler. Bir enfeksiyonun ilk birkaç saatinde kan dolaşımını terk eden ve dokularda biriken hücrelerdir ve “irin” oluşumundan sorumludurlar. Başlıca rolleri bakteri veya mantarları yutmak ve onları öldürmektir. Öldürme stratejileri, enfekte olan organizmaları özel hücre zarı paketlerinde yutmaya dayanır ve bu zar paketleri daha sonra mikroorganizmaları öldüren toksik kimyasallar içeren nötrofilin baska bölgesi ile birleşir.Virüslere karşı savunmada çok az rolleri var.
Monositler
Monositler, nötrofillerle yakından ilişkilidir ve kan dolaşımında dolaşırken bulunurlar. Beyaz kan hücrelerinin yüzde 5-10’unu oluştururlar. Ayrıca karaciğer ve dalak gibi organlardaki kan damarlarının duvarlarını da kaplarlar. Burada mikroorganizmalar geçerken kandaki mikroorganizmaları yakalarlar. Monositler kan dolaşımını terk edip dokulara girdiklerinde şekil ve boyut değiştirerek makrofaj haline gelirler. Makrofajlar, mantarları ve tüberkülozun ait olduğu bakteri sınıfını (mikobakteriler) öldürmek için gereklidir. Nötrofiller gibi, makrofajlar da mikropları yutar ve öldürmek için yabancı istilacıya toksik kimyasallar gönderirler.
Makrofajlar nötrofillerden daha uzun yaşarlar ve özellikle yavaş büyüyen veya kronik enfeksiyonlar için önemlidir. Makrofajlar, T hücrelerinden etkilenebilir ve genellikle mikroorganizmaları öldürmede T hücreleri ile işbirliği yaparlar.
Sitokinler
Sitokinler vücutta çok önemli bir protein grubudur. Bu küçük proteinler, bağışıklık sistemi için hormon görevi görür. Bir tehdide yanıt olarak üretilirler ve bağışıklık sistemi için iletişim ağını temsil ederler. Bazı durumlarda, bağışıklık sisteminin hücreleri doğrudan birbirlerine dokunarak iletişim kurarlar, ancak çoğu zaman hücreler, yerel olarak veya uzaktan diğer hücrelere etki edebilen sinyal sitokinleri salgılayarak iletişim kurarlar.
Bu akıllı sistem, tehdidin durumu konusunda vücudu uyarmak için çok kesin bilgilerin hızla iletilmesine olanak tanır. Sitokinler genellikle klinik olarak ölçülmez ancak laboratuar sonuçlarında IL-2, IL-4, IL-6, vb. olarak görünebilirler. Bazı sitokinler, interlökin (IL) numaralandırma konvansiyonu başlatılmadan önce adlandırıldıklarından, farklı adlara sahiptir.
Tamamlayıcı (Kompleman) Sistem
Kompleman sistemi, enfeksiyona karşı savunmak için düzenli bir şekilde işlev gören 30 kadar kan proteininden oluşur. Kompleman sistemindeki çoğu protein karaciğerde üretilir. Kompleman sisteminin bazı proteinleri mikropları kaplayarak nötrofiller tarafından daha kolay alınmalarını sağlar. Diğer kompleman bileşenleri, nötrofilleri enfeksiyon bölgelerine çekmek için kimyasal sinyaller gönderir. Kompleman proteinler ayrıca mikroorganizmaların yüzeyinde birleşip bir kompleks oluşturabilirler. Bu kompleks daha sonra mikroorganizmanın hücre duvarını delebilir ve onu yok edebilir.
Bağışıklık Sisteminin Enfeksiyonlarla Nasıl Savaştığına Örnekler
Bakterilere karşı
Vücudumuz bakterilerle ile kaplı, çevremizdeki çoğu yüzeyde ise bolca bakteri bulunur. Derimiz ve iç mukoza zarlarımız, enfeksiyonu önlemeye yardımcı olmak için fiziksel bariyer görevi görür. Hastalık, iltihaplanma veya yaralanma nedeniyle deri veya mukoza zarları kırıldığında bakteriler vücuda girebilir. Enfektif bakteriler, dokulara girdikten sonra genellikle komplemanlar ve antikorlarla kaplanır ve bu durum nötrofillerin bakterileri yabancı bir şey olarak kolayca tanımasını sağlar. Nötrofiller daha sonra bakterileri yutar ve onları yok eder (Şekil).
Antikorlar, kompemanlar ve nötrofillerin tümü normal olarak çalıştığında, bu işlem bakterileri etkili bir şekilde öldürür. Bununla birlikte, bakteri sayısı çok fazla olduğunda veya antikor üretiminde, komplemanda ve nötrofillerde kusurlar olduğunda, tekrarlayan bakteriyel enfeksiyonlar meydana gelebilir.
Virüslere karşı
Çoğumuz virüslere sık sık maruz kalıyoruz. Vücudumuzun virüslere karşı savunma biçimi, bakterilerle savaşma şeklimizden farklıdır. Virüsler ancak hücrelerimiz içinde yaşayabilir ve çoğalabilir. Bu onların bağışıklık sistemimizden “saklanmalarına” izin verir. Bir virüs bir hücreyi enfekte ettiğinde, hücre diğer hücreleri enfeksiyona karşı uyarmak için sitokinleri serbest bırakır. Bu “uyarı” genellikle diğer hücrelerin enfekte olmasını engeller. Ne yazık ki, birçok virüs bu koruyucu stratejinin üstesinden gelebilir ve enfeksiyonu yaymaya devam eder.
Dolaşımdaki T hücreleri ve NK hücreleri, bir viral istilaya karşı uyarılır ve virüsü barındıran belirli hücreleri öldürdükleri bölgeye gelirler. Bu, virüsü öldürmek için çok yıkıcı bir mekanizmadır. Çünkü bu süreçte kendi hücrelerimizin çoğu da feda edilebilir. Yine de, bu işlem virüsü ortadan kaldırmak için verimli bir süreçtir.
Bu sırada T lenfositleri virüsü öldürürken, aynı zamanda B lenfositlerine antikor yapma talimatı verirler. Aynı virüse ikinci kez maruz kaldığımızda, antikorlar enfeksiyonu önlemeye yardımcı olur. Hafıza T hücreleri de üretilir ve ikinci bir enfeksiyona hızla yanıt verir, bu da enfeksiyonun daha hafif seyretmesini sağlar
Anti-Bakteriyel Eylem
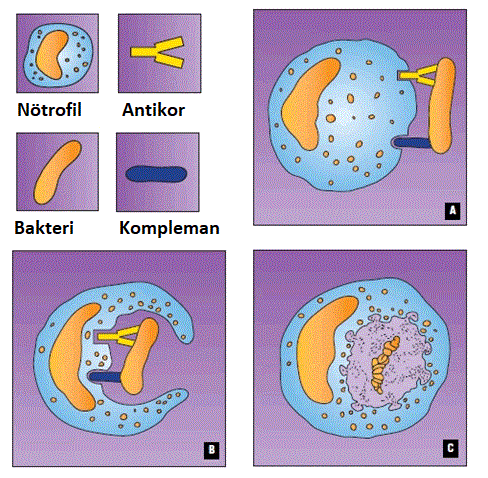
Çoğu durumda bakteriler, fagositik hücrelerin, antikorların ve kompleman sisteminin işbirliği ile yok edilir.
A. Nötrofiller (Fagositik Hücreler) bakterileri (Mikrop) tutarlaralar: Mikroplar (yani bakteri vs), spesifik antikor ve komplemanlarla kaplanmıştır. Fagositik hücre daha sonra antikora ve kompleman moleküllere bağlanarak mikroplara saldırmaya başlar.
B. Mikrobun Fagositozu: Mikroba bağlandıktan sonra fagositik hücre, mikrop etrafında genişleyerek onu içine alır ve yutmaya başlar.
C. Mikrobun Yok Edilmesi: Mikrop yutulduğunda, enzim veya kimyasal torbaları mikropları vakuole boşaltılır ve orada ölümüne sebep olurlar.
Bağışıklık Sistemi ve Birincil İmmün Yetmezlik Hastalıkları
Bağışıklık yetersizlikleri, birincil bağışıklık yetersizlikleri ve ikincil bağışıklık yetersizlikleri olarak kategorize edilir. Birincil bağışıklık yetersizliğinin nedeni bağışıklığın kendisidir ve çoğu kalıtsal olabilecek genetik kusurlardır. İkincil bağışıklık yetersizlik ise başka koşullardan kaynaklandığı için bu şekilde adlandırılır.
İkincil bağışıklık yetersizlikleri yaygındır ve başka bir hastalığın parçası olarak veya belirli ilaçların bir sonucu olarak ortaya çıkabilir. En yaygın ikincil bağışıklık yetersizliklerine yaşlanma, yetersiz beslenme, bazı ilaçlar ve HIV gibi bazı enfeksiyonlar neden olur.
İkincil bağışıklık yetersizlikleri ile ilişkili en yaygın ilaçlar kemoterapi ajanları ve bağışıklık baskılayıcı ilaçlar, kanser, nakledilen organ reddi veya otoimmün hastalıklardır. Diğer ikincil bağışıklık yetersizlikleri, bağırsaklarda veya böbreklerde protein kayıplarını içerir. Proteinler kaybolduğunda, antikorlar da kaybolur ve bu da düşük bağışıklık globülinlerine veya düşük antikor seviyelerine yol açar. Bu koşulların tanınması önemlidir, çünkü altta yatan neden düzeltilebilirse, bağışıklık sisteminin işlevi iyileştirilebilir veya geri kazanılabilir.
Altında yatan nedene bakılmaksızın, ikincil immün yetersizliğin tanınması ve immünolojik desteğin sağlanması yardımcı olabilir.
Birincil immün yetmezlik hastalıkları, bağışıklık sisteminin hücre ve proteinlerine içsel olan veya bağışıklık işlevinde meydana gelen temel kusurların neden olduğu bir grup bozukluktur. 400’den fazla birincil immün yetmezlik vardır. Bazıları nispeten yaygındır, diğerleri ise oldukça nadirdir. Bazıları bağışıklık sisteminin tek bir hücresini veya proteinini etkilerken, diğerleri bağışıklık sisteminin iki veya daha fazla bileşenini etkileyebilir.
Birincil immün yetmezlik hastalıkları birçok yönden birbirinden farklı olsa da, önemli bir özelliği paylaşırlar. Bunların tümü, T hücreleri, B hücreleri, NK hücreleri, nötrofiller, monositler, antikorlar, sitokinler ve kompleman sistem gibi normal bağışıklık sisteminin bir veya daha fazla elemanındaki veya işlevindeki bir kusurdan kaynaklanır. Bunların çoğu kalıtsal hastalıklardır ve X-Bağlantılı Agammaglobulinemi (XLA) veya Şiddetli Kombine Bağışıklık Yetmezliği (SCID) olan ailelerde görülür. Ortak Değişken Bağışıklık Yetersizliği (CVID) ve Seçici IgA Eksikliği gibi diğer birincil immün yetmezlikler her zaman kesin veya öngörülebilir bir şekilde kalıtsal değildir. Bu bozuklukların nedeni bilinmemekle birlikte, genetik ve çevresel faktörlerin etkileşiminin bunlarda rol oynayabileceğine inanılmaktadır.
Bağışıklık sisteminin en önemli işlevi enfeksiyona karşı koruma sağlamak olduğu için, birincil bağışıklık yetersizliği olan kişilerde enfeksiyona karşı artan bir duyarlılık vardır. Bu, tedavisi zor enfeksiyonları, alışılmadık derecede şiddetli enfeksiyonları veya olağan olmayan organizmalarla enfeksiyonları içerebilir. Enfeksiyonlar vücudun herhangi bir yerinde bulunabilir. Yaygın bölgeler sinüsler (sinüzit), bronşlar (bronşit), akciğer (pnömoni) veya bağırsak sistemidir (bulaşıcı ishal).
Bağışıklık sisteminin bir başka işlevi de sağlıklı doku (“kendi”) ile yabancı madde (“kendi olmayan”) arasında ayrım yapmaktır. Yabancı materyallere örnek olarak mikroorganizmalar, polen ve hatta başka bir bireyden nakledilmiş bir böbrek verilebilir. Bazı immün yetmezlik hastalıklarında, bağışıklık sistemi “kendisinden olanı” ve “yabancıyı” edemez. Bu durumlarda, enfeksiyona karşı artan duyarlılığa ek olarak, birincil immün yetmezliği olan kişilerde, bağışıklık sisteminin kendi hücrelerine veya dokularına sanki bu hücreler yabancı imiş gibi saldırdığı otoimmün hastalıklar da olabilir.
Ayrıca, bir enfeksiyona yanıt verme yeteneğinin büyük ölçüde sağlam olduğu, ancak bu yanıtı düzenleme yeteneğinin anormal olduğu birkaç birincil immün yetmezlik türü de vardır. Bunun örnekleri, otoimmün lenfoproliferatif sendrom (ALPS) ve IPEX (X’e bağlı immün yetmezlik sendromu, poliendokrinopati ve enteropati).
Birincil immün yetmezlik hastalıkları ilk olarak çocuklarda tanımlanmış olsa da, hastalık her yaştaki bireyde ortaya çıkabilir (her 1.200-2.000 kişiden 1’inin bir çeşit birincil immün yetmezliğe sahip olabileceği tahmin edilmektedir). Birçok ergen ve yetişkine birincil immün yetmezlik hastalıkları teşhisi konmuştur. Bu kısmen, CVID ve Seçici IgA Eksikliği gibi bazı bozuklukların ilk klinik görünümlerinin yetişkin yaşamda olabileceğinden kaynaklanmaktadır. Birincil immün yetmezliklerin birçoğu için tedaviler mevcuttur ve bu bozuklukları olan birçok insan nispeten normal hayatlarını yaşayabilir.
Kaynak ve Dikkat!
IDF Primer İmmün Hastalıklar Hasta ve Aile El Kitabı Bağışıklık Eksikliği Vakfı, ABD. Bu sayfa, herhangi bir vakaya güvenle uygulanamayacak genel tıbbi bilgileri içerir. Tıbbi bilgi ve uygulama hızla değişebilir. Bu nedenle, bu sayfa profesyonel tıbbi tavsiye yerine kullanılmamalıdır.