 Kanser hücreleri kontrolsüz ve hızlı çoğalırlar. Bilim dünyasında kanser hücreleri “freni patlamış, gaz pedalı basılı kalmış araba”ya benzetilir. Dolayısı ile depoda yakıt olduğu sürece araba son sürat hızla gider. Tabi, bunu yaparken çevresindeki hücrelere de zarar verir. Ta ki duvara toslayana, yani ölüme sebep verene kadar.
Kanser hücreleri kontrolsüz ve hızlı çoğalırlar. Bilim dünyasında kanser hücreleri “freni patlamış, gaz pedalı basılı kalmış araba”ya benzetilir. Dolayısı ile depoda yakıt olduğu sürece araba son sürat hızla gider. Tabi, bunu yaparken çevresindeki hücrelere de zarar verir. Ta ki duvara toslayana, yani ölüme sebep verene kadar.
Hızlı çoğaldıklarından dolayı, kanser hücreleri daha çok yemeye ve içmeye ihtiyaç duyarlar. Dolayısı ile kanser hücresine hiç doymak bilmeyen “obez” birşey gibi bakabiliriz. Bu nedenle, kanser hücreleri çoğalmalarını desteklemek için proteinleri yapan amino asitler, DNA ve RNA’yı yapan nükleotidler ve yağlar gibi hücrenin gerekli yapı taşlarını tedarik etmek için metabolik ayarlamalar yaparlar.
Normal hücrelerden farklı olarak, kanser hücreleri yüksek seviyede glükoz (kan şekeri) kullanırlar. Normal hücreler oksijen varlığında glükozu tamen parçalarlarken, kanser hücreleri oksijen olsa da olmasa da glükozu kısmen parçalarlar. Oksijen yokluğuna fazla dayanamayan normal hücrelerin tersine, kanser hücreleri oksijensiz ortamda da rahatça büyüyüp çoğalırlar. Hatta kanser hücreleri oksijensiz ortamda daha çok glükoz tüketirler (Warburg Etkisi).
Kanser hücrelerinin glukozu tam parçalamamalarının tabi bir sebebi vardır: büyümeleri için gerekli maddeleri sağlamak. Dolayısı ile, glükozun kısmen parçalanmasından açığa çıkan maddeler kanser hücrelerin büyümesi için kullanılır.
Kanser hücrelerinin “metabolizma” dediğimiz yeme-içme, enerji ve yapı taşı oluşturmak için başvurdukları bu yeniden programlama olayını şimdi biraz açalım…
Kanserli hücrelerinin değişik bir metabolizma sergilediği fikri yeni değil…
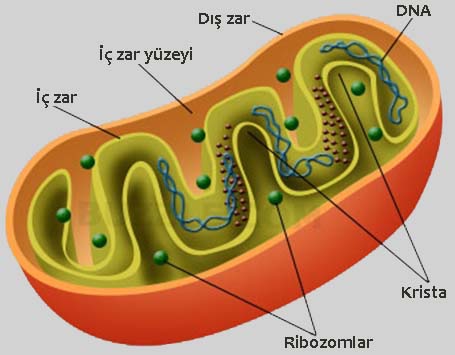
Bu olay ta bundan nerede ise bir asır önce Alman biyokimyacı Otto Warburg tarafından gösterildi ve dolayısı ile “Warburg Etkisi” olarak da bilinmektedir. Warburg geliştirdiği kalorimetrik tekniklerle (besinlerin yakılmasından ortaya çıkan ısı ve enerjinin ölçülmesi) tümör hücrelerinde ve normal dokulardaki hücrelerde enerji üreten iki önemli yolun enerji oranlarını karşılaştırdı. Bu yolaklardan birincisi 6 karbonlu glükozun 3 karbonlu iki piyruvata kısmı parçalanmasını sağlayan ve hücrenin sitozol dediğimiz sıvı kısmında yer alan “glikoliz” yolağıdır.
Glikoliz?
Glikoliz, “şekerlerin erimesi veya bölünmesi” anlamına gelip, şekerlerdeki enerjiyi açığa çıkarma sürecidir. Glikolizde, glukoz (altı karbon şeker) üç karbonlu iki piruvat molekülüne bölünür. Bu yolakta iki molekül ATP (serbest enerji içeren molekül), iki molekül piruvat ve iki molekül “yüksek enerjili” elektron taşıyan NADH üretilir. Glikoliz oksijen olsun veya olmasın meydana gelebilir. Oksijen varlığında, glikoliz hücresel solunumun ilk aşamasıdır. Oksijenin bulunmaması durumunda, glikoliz, hücrelere fermantasyon süreci boyunca az miktarda ATP yapabilmelerini sağlar. Glikoliz, hücrenin sitoplazmasında gerçekleşir.
İkincisi ise hücrelerde enerji dinamosu olarak rol alan ve enerjimizin (yani ATP’mizin) % 90’ını sağlayan mitokondri denen organelde peş peşe gerçekleşen 3 “hücresel solunum” yolağıdır (Krebs Döngüsü + Elektron transfer Zinciri ve Oksidatif Fosforilasyon). Krebs Döngüsü, glikoliz yolağı ile kısmen parçalanmış ürünün yani piruvatın tamamen parçalandığı bir döngüdür.
Krebs Döngüsü?
Trikarboksilik Asit (TCA) Döngüsü veya Sitrik Asit Döngüsü olarak da bilinen Krebs Döngüsü hücresel solunumun ikinci evresidir. Yediğimiz yiyecek ve içeceklerdeki karbonhidratlar, proteinler ve yağlarda bulunan kullanılabilir enerji esas olarak bu döngü ile salınır. Sitrik asit döngüsü doğrudan oksijen kullanmamasına rağmen, oksijen yokluğunda çalışmaz. Oksijen varlığında glikolizin son ürünü olan 2 adet 3 karbonlu piruvatın her biri mitokondriye taşınır ve orada her bir piruvat birer asetil CoA denen 2 karbonlu enerjetik moleküle çevrilir. Asetil CoA Krebs Döngüsü ile tamamen parçalanır. Her bir asetil CoA’nın parçalanması ile 2 CO2, 3 NADH ve 1 FADH2 ve 1 ATP ortama salınır. Yüksek enerjili elektronları taşıyan NADH ve FADH2 daha sonra bu elektronlarını Elektron Transfer Zincirine aktarır. Böylece NADH ve FADH2’den gelen elektronların transferi ile bir proton gradienti oluşur ve bu gradiyent vasıtası ile daha çok ATP ürteilir (oksidatif fosforilasyon).
Warburg, oksjen yokken normal hücrelerin enerji bakımından zayıf bir yolak olan glikolizi pek yapamadıklarını, kanser hücrelerine bu etkinin görülmediğini ve hatta oksijensizlik durumunda bu hücrelerin glikoliz aktivitesinin arttığını gösterdi. Buna aerobik glikolizis adı verildi.
Bu durum bugün klinikte kanser tümörlerinin işaretelenip belirlenmesinde bile kullanılmaktadır. Hastalara enjekte edilen ve bir glükoz analogu olan flurodeoksiglukozözllikle tümörlerde birikir. Çünkü kanser hücreleri glükozu normal hücrelere göre nerede ise 20 kata daha fazla kullanır. Ancak glükozdan farklı olarak bu analog madde parçalnmaz ve dolayısı ile tümörlerde birikir. PET scan olan pozitron emisyon tomografi cihazı (röntgen gibi bir cihaz) kullanılarak hastanın vücudunda tümör olup olmadığı belirlenir.
“Aerobik glikoliz” genel olarak kanserin 10 işaretinden biri sayılmaktadır. Diğerleri mi?
Warburg, kanserli hücrelerin işlevsiz mitokondrilere sahip olduğunu ve dolayısıyla enerji için glikolitik metabolizmaya ihtiyaç duyduklarını öne sürdü. Ancak, daha sonra birçok kanser hücresinin mitokondriyal solunumu gerçekleştirebildiği anlaşıldı. Dolayısı ile organeller işlevsel olmalı idi. Ayrıca, mitokondrisi olmayan bazı hücreler (örn, kırmızı kan hücreleri) glikolitik metabolizma ile kanser hücreleri gibi yüksek seviyede glikoz tüketebiliyordu.
Alternatif bir hipotez ise, artan glikolizin kanser hücrelerinin hızlı hücre çoğalması için gerekli olan temel metabolik prekürsörleri sağlamasındaki rolü idi. Örneğin, glikolizin ara maddeleri, nükleotid ve DNA biyosentezi için öncül üreten pentoz fosfat yolunaaktarılabilirdi. Bu ara maddeler ayrıca, nükleotid ve protein sentezi için gerekli olan çeşitli amino asitleri yapmak için kaynak sağlayabilir.
Son yıllarda, kanser hücrelerinin, glikolizin son aşamasını katalize eden, düşük aktiviteli bir piruvat kinaz formu (PMK2) taşıdıkları bulgusu, hücre çoğalmasında glikolitik ara maddelerin kritik rolünü daha da desteklemektedir.
Glikoliz olan yüksek bağımlılığına rağmen, çoğu kanser hücresi çoğalmak için aktif mitokondriyal solunuma da gerek duyar. Bu, enerjiye olan ihtiyaçtan değil, proteinlerin yapısına girmesinin yanı sıra nükleotid sentezinin bir öncüsü olan amino asit aspartata olan ihtiyaçtan kaynaklanır. Bu nedenle, fonksiyonel mitokondrileri olmayan yani hücresel solunum yapamayan ve de dolayısı ile aspartat üretemeyen kanser hücrelerinin aspartat açlığı çektiği ve sırf bu nedenle öldükleri görülmüştür. Tabi bu durum sadece aspartat için de geçerli değil. Birçok, diğer amino asit ve lipid de mitokondrideki Krebs Döngüsü ara ürünlerinden oluşur ve buradan sitoplazmaya geçerler.
Kanser hücrlerinde glukozun sadece bir kısmı Krebs Döngüsüne katılır. Geri kalan kısmı laktik asite çevrilir. Dolayısı ile kanser tümötlerinin çoğu bol miktarda laktik asit ürettiğinden, asidik bir çevreye sahiptirler. Son yıllarda kanser hücrelerinin bu asit çevresini hedef alan terapötik yaklaşımlar da bulunmaktadır.
 Kanserde Metabolik Yolakları Hedefleme
Kanserde Metabolik Yolakları Hedefleme
Kanser hücrlerinde yeniden ayarlanan metabolik yolların birçoğu yeni antikanser tedavileri için hedef görevi görebilir.
Metabolizmaya dayalı kanser tedavileri geliştirmeye yönelik ilk girişmler DNA sentezinin bloke edilmesine odaklı idi. Bir vitamin olan folatın uygulanmasının DNA’nın yapı taşları olan nükleotidlerin oluşması için kritik öneme sahip olduğu görüldü. Hatta folat alan hastalarda löseminin (kan kanseri) şiddetli bir şekilde ilerlediği gözlendi. Sentetik yani hücreler tarafından parçalanmayan folat analogları (anti-folat) kullanıldığında kanserin önlendiği görüldü. Bugün anti-folat ilaçlar (örn., Metotreksat) meme ve kan kanserleri için standart kemoterapinin bir parçası olarak rutin olarak kullanılmaktadır.
Daha en başta kanser hücrelerinin kontrolsüz büyüyüp çoğaldıklarını söylemiştik. Bunun sebebi hücrelerin yeme içmesini düzenleyen ve büyüyüp bölünmesini sağlayan genlerin kanser hücrelerinde mutasyonlarla sıvanmış olmasıdır. Dolayısı ile bu genleri kontrol eden elemanlar (büyüme faktörleri, vs) görevlerini yapamaz.
Örnek mi?
Kanser hücrelerinde insüline tepki olarak glükoz metabolizmasına aracılık eden fosfoinositid 3-kinaz (PI3K) yolağı; Normalde PI3K sinyali yolağı ile insülin hormonu, kas ve yağ gibi dokulardaki glikoz alımını arttırır. Ancak, birçok kanser hücresinde, PI3K yolağının çeşitli bileşenleri (transkripsiyon faktörleri, vs) mutasyona uğramışlardır ve dolayısı ile bu hücrelerde insülinden bağımsız olarak çalışan ve yüksek seviyelerde glükoz alımını sağlayan anormal bir durum vardır.
Kısaca kanser kaostan beslenir! ve normal hücrelerin tersine bu hücrelerin ne yapacağını kestiremezsiniz. Çünkü kanser hücrelerinde yavru ebeveynine, ebeveyni atasına benzemez. Bunun nedeni her yeni doğan bir kanser hücresi farklı mutasyonlar taşır. Bu nedenle kanserler tedaviye belirgin şekilde farklı yanıtlar gösteren farklı tümör tiplerine sahip oldukça heterojen bir hastalıklardır.
Sinyal bileşenlerine ilaveten, metabolik enzimlerin mutasyona uğraması ve doğrudan tümör oluşumuna katkıda bulunabileceğine dair de artan kanıtlar vardır. Örneğin, Krebs döngüsü enzimlerinden süksinat dehidrogenaz (SDH) ve fumarat hidrataz (FH) enzimlerindeki genetik kusurlar nadir görülen böbrek ve endokrin kanserlerine yol açar. Bu enzimleri kodlayan genler klasik tümör baskılayıcılar gibi davranır; bir mutant alel genellikle kalıtsaldır, daha sonra somatik hücrelerde ikincisinde oluşacak bir mutasyon kanser oluşumuna neden olur. Bu enzimlerin inaktif olması veya hiç olmaması, süksinat ve fumaratın birikmesine neden olur. Bir başka Krebs döngüsü geni, izositrat dehidrogenaz(IDH), bir onkogen (kanser geni) gibi davranıyor; tek bir aleldeki bir mutasyon bile kanser oluşumu için yeterlidir. Ancak burada mutasyon, enzimde aktivite kaybına neden olmayıp, onun işlevini değiştirir: 2-hidroksiglutarat (2-HG) olarak adlandırılan alternatif bir metabolitin sentezine sebep olur.
İnsan serumunda yaklaşık 5000 metabolit bulunur ve farklı kanserler bu metabolitlere farklı bağımlılıklar gösterebilir. Metabolik bozukluklarda metabolit birikimi sık görülür. Bazı metabolitlerin birikiminin neden toksik olduğu belli değildir. Bu metabolitlerin (örn., süksinat, fumarat ve 2-HG) birikiminin, normal hücrelerin epigenetik programını bozarak (yani DNA metilasyonunu değiştirerek) kansere neden olduğu düşünülmektedir.
 Tümör Çevresi
Tümör Çevresi
Kanser hücrelerinin yukarıda anlattığımız garip metabolizmasını etkileyen bir diğer önemli faktör, içinde yaşadıkları ortamdır. Hızla büyüyen tümörlerdeki kanser hücreleri oksijen ve besinlere karşı açlık çekerler ve toksik atıklara maruz kalırlar. Bunun nedeni, besin tüketiminde arzın talebi karşılayamaması ve işlevsiz damar yapısının ortaya çıkmasıdır.
Buna uyum için, kanser hücreleri glikolitik enzimleri ve glükoz taşıyıcılarını ve düşük oksijenle ortaya çıkan hipoksi indüklenebilir faktörü (HIF) adı verilen bir transkripsiyon faktörünü oldukça aktive ederler. Kanser hücrelerinin glikolizi esas yolak olarak kullanması, hücrelerin mitokondriyal solunuma ve dolayısıyla oksijene bağımlılığını azaltır.
Düşük oksijen, moleküler oksijen gerektiren metabolik enzimlerin işlevini de etkiler. Örneğin lipid desatürazlar yağ asiti zincirlerini “doymamış” hale getiren karbon-karbon çift bağlarını oluşturmak için oksijen kullanır. Bu doymamış yağ asitleri, hücre zarının kritik bileşenleri olup, onun akışkanlığına ve geçirgenliğine katkıda bulunur. Dolayısı ile tümörlerdeki düşük oksijen seviyeleri, doymamış yağ asitlerinin oluşumunu engelleyerek, doymuş yağ asitlerinin birikmesine sebep olur. Bu da hücre zarının molekülleri etkili taşımasını önler. Bu dengesizliğin üstesinden gelmek için, birçok kanser hücresi ihtiyaç duydukları doymamış yağ asitlerini yerel çevrelerinden, bazı durumlarda yakındaki lipid zengini adipositlerden (yağ hücreleri) transfer edilebilir. Dolayısıyla, kanser hücrelerini öldürmek için düşük oksijen koşullarında lipid satürasyonu (doygunluğu) ve taşımasının hedeflenmesi potansiyel teşkil edebilir .
Klinikte kanser metabolizmasının hedef alındığı bir başka örnek de kendi laboratuvarımızda klonlayıp ürettiğimiz ve kan dolaşımında asparajin amino asitini yıkan bir enzim olan asparajinaz uygulamasıdır.
Bu konudaki yayınlarımıza buradan bakılabilir:
P1,
P2,
P3,
P4,
P5.
Kanser hücrelerinin genleri mutasyonlarla sıvandıklarından, birçok enzimi yapan genler bu hücrelerde normal işlevsel enzimleri veya proteinleri yapamazlar. Dolayısı ile kanser hücreleri bu enzimler tarafından yapılan maddeleri çevrelerinden almak zorundadır. Bu maddeler kanser hücrelerine iki şekilde sağlanır: yiyecek ve içeceklerden veya normal hücreler tarafından yapılıp kana salınanlar. Çevredeki bu maddeleri ortadan kaldırırsanız, normal hücrelere birşey olmazken (çünkü onlar o maddeleri zaten kendileri yapabiliyor), kanser hücreleri aç kalır.
Yukarıda örneğini verdiğimiz asparajinde de durum budur. Bu amino asit normal hücreler tarafından ihtiyaç duyuldukça yapılır. Çünkü bu hücreler bu amino asiti yapan işlevsel bir asparajin sentaz enzimine sahiptir. Ancak, kanser hücrelerinde bu enzim mutant olduğu için işlev yapamaz ve dolayısı ile asparajin amino asiti sentezlenemez. Kanser hücreleri bu amino asiti çevrelerinden (tümör mikroçevresi) almak zorundadırlar.
Obezite ve insülin direnci genellikle kanser riskinin artması ile ilişkili olduğundan, son zamanlarda metformin ve fenformin gibi antidiyabetik ilaçlar antikanser etkileri olup olmadığı araştırılmıştır. Metformin ile tedavi edilen insanlarda dolaşımdaki insülin düzeylerinde bir azalma olmaktadır. Bilindiği gibi insülin, yukarıda bahsttiğimiz PI3K yolu boyunca kanser hücresi büyümesini ve besin alımını teşvik etmektedir.
Kanserli hücre metabolizması üzerine yapılan araştırmalar ve halihazırda kullanılan metotreksat ve asparaginaz gibi ilaçlara dayanan heyecan verici yeni terapötik yaklaşımlar kanser hücrelerindeki metabolik zayıflıkların daha iyi anlaşılmasını sağlayacaktır.







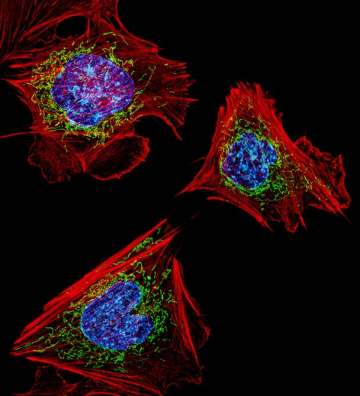
 Çalışmada aynı zamanda açlığın, yağ asidi oksidasyonunu düzenleyen ve yine bir tür organel olan peroksizomlarla mitokondriler arasındaki koordinasyonu arttığı gösterilmiş.
Çalışmada aynı zamanda açlığın, yağ asidi oksidasyonunu düzenleyen ve yine bir tür organel olan peroksizomlarla mitokondriler arasındaki koordinasyonu arttığı gösterilmiş.


 Kanserde Metabolik Yolakları Hedefleme
Kanserde Metabolik Yolakları Hedefleme

 2017 Nobel Kimya Ödülü birkaç saat önce belli oldu. İsimleri duyduğumda bunlar da kim dedim! Çünkü Kimya ödülüde genellikle biyologlara veriliyor. Geçen yıl bu ödülü alan Aziz Sancar bir biyolog…
2017 Nobel Kimya Ödülü birkaç saat önce belli oldu. İsimleri duyduğumda bunlar da kim dedim! Çünkü Kimya ödülüde genellikle biyologlara veriliyor. Geçen yıl bu ödülü alan Aziz Sancar bir biyolog…