(1Yüksek Lisans Öğrencisi; 2Öğretim Üyesi)
Koronvirüsler
Coronavirüsler bir grup büyük, zarflı,
pozitif zincirli, tek sarmallı RNA virüsleridir. İki düzine kadar farklı türü,
farklı antijenik çapraz reaktiviteleri ve genetik yapı bakımından dört grubu
vardır (alfa, beta, gama ve delta). Sadece alfa ve beta-coronavirüs cinsleri,
insan ve diğer memeliler için patojenik (hastalığa sebebiyet verici) suşları
içerir. (Paules, C.I. ve diğerleri (2020); Chen, Y. ve diğerleri (2020)).
Bununla birlikte, koronavirüsler
insanlarda en az 500-800 yıldır buluna gelmekte ve hepsi de yarasa kaynaklıdır.
(Chan, P.K. et al (2013); Berry, M. et al (2015)).
Coronavirüsler uzun zamandır önemli
veterinerlik patojenleri olarak bilinmekte ve memelilerde ve kuşlarda solunum
ve enterik hastalıklara sebep olmaktadır. (Skariyachan, S. et al (2019).
SARS-CoV ve MERS-CoV, betacoronavirüslerdir (Chen, Y. et al, (2020)) ve Dünya
Sağlık Örgütü’nün “Blueprint Öncelik Hastalıklar Listesi”nde yer alan
patojenler arasındadırlar (Bonilla-Aldana, D.K. et al, (2020)).
Koronavirüslerin bol bulunurlukları ve
geniş dağılımı göz önüne alındığında, büyük genetik çeşitçililikleri ve ayrıca
genomlarının sık rekombinasyonu (kırımı) ve insan-hayvan arasındaki ara yüzde
bulunmaları, onları insan sağlığı için büyük tehdit yapmaktadır. (Hui, D.S. et
al (2020); Zhu, N. et al (2020)).
Bu gerçek, 2019’un sonları ve 2020’nin
başlarında, Wuhan, Çin’de potansiyel ölümcül zatürree dahil olmak üzere solunum
hastalıklarına sebep olan ve büyük ve hızla yayılan yeni koronavirüsün salgını
ile kendini gösterdi. (WHO Bildirgesi).
Virüs geçici olarak 2019-nCoV olarak
adlandırıldı. Ancak, daha sonra SARS-CoV virüsüne benzerliği nedeniyle
SARS-CoV-2 resmi adı verildi ve viral genomu dizilendi. SARS-CoV-2
betacoronavirüs olarak karakterize edildildi ve insanda hastalığına neden olan
yedinci koronavirüs türü olarak tanımlandı. (Zhu, N. et al (2020)).
Virüsün neden olduğu hastalık, WHO (Dünya
Sağlık Örgütü) tarafından Coronavirus Hastalığı 2019 (Covid-19) olarak
adlandırıldı.
Koronavirüsler, influenza, parainfluenza,
RSV ve rinovirüslerle birlikte soğuk algınlığı dahil olmak üzere hafif,
kendiliğinden biten üst solunum yolu enfeksiyonlarına ve zatürreeye sebep
olurlar (Chan, J.F. et al (2015)) ve soğuk algınlığı vakaların üçte birinden
sorumludurlar. Coronavirüsler ayrıca insanlarda gastroenterite ve diğer
hayvanlarda çok sayıda hastalığa neden olurlar (To, K.K. et al (2013); Berry,
M. et al (2015)). İnsanlarda patojenik diğer koronavirüslerin aksine, SARS ve
MERS ciddi akut solunum yolu hastalığına ve çoklu organ yetmezliğine neden
olabilirler (Zumla, A. et al (2016)).
SARS-CoV hakkında
gerçekler
Şiddetli akut solunum sendromu (SARS)
koronavirüsün neden olduğu yeni bir viral bir hastalık olup, solunum sistemini
etkilemektedir. Kasım 2002’de Çin’in Guandong eyaletinde ve 2003 yılının
başında Asya’da rapor edilmiştir (Heymann, D.L. et al (2013)). 2003
ilkbaharında SARS küresel bir sağlık tehdidi haline geldi. Hastalık 2003’ten
beri yok olmasına rağmen, SARS’ın hızlı küresel yayılımı bunun ve ilgili
koronavirüslerin sürekli gözetim altında tutulması gerektiğini gösterdi.
SARS’tan alınan dersler uluslararası
düzeyde de etkili bir şekilde uygulandı ve daha sonra 2012 yılında farklı bir
koronavirüs türünden kaynaklanan Orta Doğu Solunum Virüsü (MERS-CoV) salgını
ile mücadelede yol gösterici (Cheng, V.C. et al (2013); Tevfik, J.A. et al
(2014); Zumla, A. et al (2015)). Bu dersler 2020’de tekrar teste tabi tutuldu:
Çin’de ve daha sonra küresel ölçekte Covid-19’un ortaya çıkışı ve yayılması
(Perlman, S. (2020)).
SARS-CoV’nin
Morfolojisi, Yapısı ve Replikasyonu
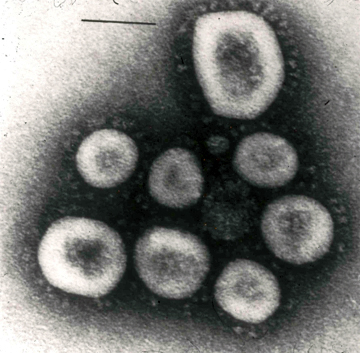
SARS-CoV virionu küreseldir ve ortalama 78
nm çapındadır (nm, milimetrenin milyonda biridir). Sarmal nükleokapsid bir zarf
ile çevrilidir (Goldsmith, C.S. et al (2004)). Ağdan oluşan zarf, yaklaşık 20
nm uzunluğunda tokmak şeklinde, uzun çıkıntı (Spike, S) ve diğerbirkaç
proteinle kaplıdır ve tipik taç benzeri (corona) bir görünümü vardır.
Koronavirüsler hücrelerin yüzeyindeki bir
reseptöre bağlanarak membran füzyonu yoluyla hücreye girerler. ACE2, SARS-CoV
için hücre reseptörü olarak tanımlandı (Wan, Y. et al (2020)). SARS-CoV’un
hedef hücreler girişi antiviral aktiviteye sahip olan polianyon (çoklu negatif
yüklü) bileşikleri tarafından inhibe edilir. Bu veriler, SARS-CoV zarf
proteoglikan proteinlerinin pozitif yüklü olabileceğini göstermektedir. Çünkü,
polianyon bileşiklerdeki heparan sülfatın negatif yükleri ile etkileşerek hedef
hücrelerin yüzeyine yapışır (Vicenzi, E. et al (2004)). SARS-CoV, enfeksiyon
için endozomların asitleştirilmesini gerektirir ve bu da pH’a bağlı bir
mekanizmaya işaret etmektedir (Simmons, G. Et al (2004)). Koronavirüsler,
sitoplazmada çift zarla çevrili erlen (tabanı geniş üst kısmı boyunlu özel bir
deney şişesi) gibi bir yapı içinde viral RNA’larını çoğaltırlar. (Gosert, R. et
al (2002)).
Çevrilecek ilk gen, replikaz adı verilen
viral bir RNA polimerazdır. Bu enzim, genomu tam uzunluklu boyunca negatif
zincir (veya antisens) kopyalara çoğaltır. Bu negatif zincirler daha sonra
viral genleri kopyalayan mRNA’ları üretmek için şablon olarak kullanılırlar. Bu
subgenomik transkriptler iç içe geçmiştir ve ifade olmayan aynı 5 ‘bölgelerine
ve poli-A 3 ‘kuyruklarına sahiptir. Farklı, iç içe geçmiş transkriptler
birleştirme (“splays”) ile değil, viral RNA polimeraz ile üretilirler. Viral
RNA polimeraz tekrarlanan bir intergenik dizi ile etkileşir (TRS,
transkripsiyon regülasyon sekansı). Bu diziler, viral genler arasında bulunur
ve 5’ lider dizisi ile her genin başlangıç noktası arasındaki bağlantıyı
sağlar. Replikasayon mekanizması tam olarak tanımlanmamıştır. Ancak
subgenomik boyutta, lider diziyi içeren eksi (-) zincir RNA’lar üzerinden
olması muhtemeldir. Diğer koronavirüslerin enfekte ettiği hücrelerde görülen
RNA ve protein içeren büyük granüler bölgeler, SARS-CoV tarafından enfekte olan
hücrelerde görülmeyebilir. (Goldsmith, C.S. et al (2004); Song, Z. et al
(2019)).
Viral parçacıklar Golgi’de toplanır ve
burada dilate (şişmiş) veziküllerde birikir ve daha sonra hücre yüzeyine
taşınır ve ekzositoz ile dışarya salınırlarlar.
SARS-CoV, bilinen koronavirüslerden farklı
biyolojik özelliklere sahiptir. Düşük sıcaklıkta çoğalan diğer
koronavirüslerin aksine SARS-CoV 37ºC’de çoğalır ve alt solunum yollarını
enfekte edebilir (Vicenzi, E. et al (2004)). SARS-CoV genomu 29705 and 29751
nükleotid arasındadır (NCBI Sequence Viewer: SARS coronavirüs) ve genomu
önceden bilinen üç koronavirüs grubundaki hiçbir koronavirüsle eşleşmemiştir.
SARS-CoV organizasyonu, gen düzeni ile
diğer koronavirüslerin organizasyonuna benzer; 5 ‘, replikaz [rep], skipe [S],
zarf [E], membran [M], nükleokapsid [N], ifade edilemeyn kısa bir dizi ile
biten 3’ bölgesi. (Du, L. et al (2009); Song, Z. et al (2019)). Potansiyel
olarak beş adet yapısal olmayan protein kodlayan diziler (ORF, açık okuma
çerçevesi) S ve N arasında serpiştirilmiştir. Genom, potansiyel olarak 11 adet
açık okuma çerçevesi içerir ancak toplam 23 kadar olgun protein kodlar. (Ruan,
Y.J. et al (2003)). ORFlar genomun üçte ikisini kaplar ve iki ana poliproteini
kodlar: ORF1a ve ORF1b. Poliproteinler yapısal olmayan proteinler üretmek için
proteoliz ile parçalanırlar. En önemli ürünler RNA’ya bağlı RNA polimeraz
(RdRp) ve bir ATPaz helisazıdır (Hel). SARS-CoV’un farklı izolatlar arasında
komple nükleotit sekansı sadece birkaç pozisyonda değişmiştir.
SARS-CoV’un orijini
Farklı hayvan koronavirüsleri RNA’larını
birleştirebilirler (rekombinasyon) ve bu da yeni virüsleri ortaya çıkarabilir.
Böylece bu, SARS-CoV’nin bir hayvan ile bir insan virüsü arasındaki
rekombinasyon olayının bir sonucu olarak ortaya çıkmış olabileceği hipotezine
yol açtı. (Chan, P.K. et al (2013)).
Virüsün insanlar için nasıl bulaşıcı hale
geldiği bilinmemektedir. SARS-CoV’un bilinen insan koronavirüs suşlarının
herhangi biri ile dizi homolojisi göstermemesi, insanlardaki koronavirüsler
arsında bir rekombinasyon sonucu SARS-CoV’un ortaya çıkması ihtimalini zayıf
kılmaktadır.
Serolojik testler, SARS-CoV ortaya çıkan
bölgelerde vahşi hayvan ticareti ile uğraşanların % 40’ında ve bu hayvanları
kesenlerin %20’sinde SARS-CoV antikorlarına rastlandı. Ancak bunların hiç biri
SARS benzeri belirtiler göstermiyordu (Berry, M. et al (2015)). Bu nedenle SARS
benzeri bir koronavirüs, SARS salgınından en az iki yıl önce muhtemelen bölgede
mevcuttu. Başlangıçta bulaşıcı olmayan virüs insanlarda, SARSCoV’ye yol açmak
için evrimleşmiş ve insanlara adapte olmuş olabilir.
SARS-CoV’un konakçılara
geçişi
SARS koronavirüsü büyük damlacıklar ve
doğrudan temas yoluyla bulaşmıştır. (Wong, S.S. et al (2008)). Virüs balgam
veya tükürükte ml başına yaklaşık 100 milyon parçacık konsantrasyonuna
ulaşabilir. (Drosten, C. et al (2003)) oda sıcaklığında 6 güne kadar
yaşayabilir (Cleri, D.J. et al (2010)).
SARS’ın hızla yayılmasına iki önemli
faktör katkıda bulunmuştur; Birincisi uluslararası nüfusun yoğun hava
yolculuğu, ikincisi, özellikle Asya kıtasındaki kentsel nüfus yoğunluğunun
kişiden kişiye geçişini hızlandırması. (Arita, I. et al (2003)).
Belirtiler ve Hastalık
SARS-CoV büyük oranda alt solunum
yollarını enfekte eder. Şiddetli, akut viral bir zatürreye neden olur. WHO
(Dünya Sağlık Örgütü) olası SARS için vaka tanımı: yüksek ateş (> 38 ° C)
veya 48 saat öncesine ait ateş; pnömoni düşündüren göğüs sızıntıları gösteren
röntgen, grip benzeri belirtiler (titreme, öksürük, halsizlik, kas ağrısı) veya
maruz kalma öyküsü; SARS için testte bir veya daha fazla pozitif tanı. (Cleri,
D.J. et al (2010)). Ne yazık ki, erken belirtiler ve klinik görünüm diğer
yaygın solunum yollarından kolayca ayırt edilemeyebilir, enfeksiyonlar ve ateş
yaşlı erişkinlerde olmayabilir.
Hem otopsi örneklerinin hem de deneysel
olarak enfekte olmuş hayvanların analizi SARSCoV’un akciğer enfeksiyonunda
pnömonik bölgeleri etkiler ve tip 2 pnömositlerde tespit edilir.(Gralinski,
L.E. et al (2015)). Dokulardaki morfolojik değişiklikler yaygın alveoler
hasarı, bronşiyal epitelyumun aşınması, siliya kaybı ve skuamöz metaplaziyi
içerir.
Solunum yolu, SARS-CoV’un ana hedefi
olmasına rağmen, gastrointestinal sistem de buna dahil edilebilir. (Paules,
C.I. et al (2020)). Ayrıca, merkezi sinir sisteminde enfeksiyon da rapor edildi
(Lau, K.K. et al (2004); Zhang, D.M. et al (2008)).
2003 salgını sırasındaki SARS semptomları
tüm hastalarda aynı değildi. Neredeyse yetişkin ve çocukların % 100’ü ateş,
yaklaşık yarısı öksürük ve / veya kas ağrısı için başvurdu. Sadece birkaç
hastada üst solunum yolu semptomları vardı. İshal, hastaneye ilk gelenlerin %
11-15’inde (Cleri, D.J. et al (2010)), yatan hastaların ise to 40-70% ine
görülmüştür. (Hui, D.S. (2005)).
Laktat dehidrogenaz, aspartat
aminotransferaz ve kreatinin kinaz enzimlerinin yüksek seviyeleri SARS’ın
karaciğer üzerindeki etkisine delalet eder (Drosten, C. et al (2003): Cleri,
D.J. et al (2010)). Pulmonar sızıntılar göğüs radyografisinde açık görünüyordu.
Akciğer dokusundaki değişiklikler sitokin ve kemokinlerin verdiği hasara işaret
eder (Gralinski, L.E. et al (2015)).
Salgın sırasında, enfekte hastaların
yaklaşık% 40’ında solunum yetmezliği için Vantilasyon kullanıldı. Ancak
hastaların% 90’ı ilk görünümden sonraki bir hafta içinde iyileşme belirtileri gösterdi.
Yaşlı hastalarda, yaşlanma ile ilişkili bir zayıflamanın sonucu olarak ortaya
çıkan zayıf adaptif (kazanılmış) bağışıklık yanıt sonucu daha fazla morbidite
(hastalığın şiddet seviyesi) ve mortalite (ölüm) görüldü. (Frieman, M. et al
(2008); Schäfer, A. et al (2014)).
SARS-CoV-2 ve COVID-19
Hakkında Gerçekler
2019 sonlarında, yeni koronavirüs Çin’de
ateşli solunum hastalığına neden olmaya başladı; iki ay içinde hızla yayılan
hastalık resmi olarak WHO tarafından Coronavirus Hastalığı 2019 (Covid-19) olarak
adlandırıldı. Hastalık ilk kez Hubei eyaletinin yoğun nüfuslu bir şehri olan
Wuhan’daki doktorlar tarafından rapor edildi. Vakalar Wuhan’daki toptancı deniz
ürünleri pazarına bağlandı ve pazar hemen kapatıldı. İlk vakalarda zoonotik
(hayvanlardan) bulaşma izlenmesine rağmen, kısa süre sonra hastane ve ailelerde
insandan insana bulaşma vakaları rapor edilmeye başlandı. (Chan, J.F. et al
(2020); Li, Q. et al (2020)). Esasen, tür bariyeri arasındaki ilk sıçramayı
(hayvandan insana geçmesini) takiben, insandan insana bulaşma daha hızlı olmaya
başladı (Chen, J. (2020)); Hastalık tek bir noktadan, sadece 30 gün içinde
Çin’in her terafına yayıldı (Wu, Z. et al (2020)).
Hastalığa sbep olan virüs başlangıçta
2019-nCoV olarak adlandırıldı ve dizi analizi onun sarbecovirus alt cinsine ait
betacoronavirüs olduğunu, ve virüsün genetik dizi bazında yaklaşık %80 (Hui,
D.S. et al (2020); Zhu, N. et al (2020); Perlman, S. (2020)), bazı elzem
enzimlerinin amino asit dizileri bakımından %90’ın üzerinde SARS-CoV’a benzediğini
gösterdi (Morse, J.S. et al (2020)).
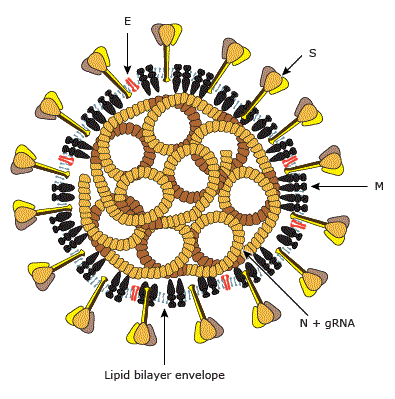
Viral genom, pozitif tek zincirli bir RNA
olup yapısal proteinleri (özellikle spike [S]) ve yapısal olmayan
(3-kimotripsin benzeri proteaz, papain benzeri proteaz, helikaz ve RNA’ya bağlı
RNA polimeraz) proteinleri ve yardımcı proteinleri kodladığı görüldü (Li, G. et
al (2020); Zhang, L. et al (2020)). SARS-CoV gibi, yeni virüsün de hücreye
girmek için kendi S proteinini kullanarak hücre yüzeyindeki ACE2 reseptörüne
bağlandığına inanılıyor. (Wan, Y. et al (2020)), (Li, G. et al (2020)).
SARS-CoV virüsüne bu benzerliklerinde dolayı, Uluslararası Virüs Taksonomisi
Komitesi (ICTV) Coronavirüs Çalışma Grubu bu yeni virüse SARS-CoV-2 adını
verdi. SARS-CoV-2’nin muhtemel doğal ara konakçısının Wuhan Canlı Hayvan
Marketinde satılan yarasalar olduğu düşünülüyor. (Perlman, S. (2020); Lu, R. et
al (2020)). Normalde, yarasalarda bulunan coronavirüsler insanı doğrudan
enfekte edemezler. (Wang, R. et al (2020)).
2-14 gün (ortalama 6.5 gün) arasında bir
inkübasyonun ardından Covid-19,ateş, öksürük ve nefes darlığı şeklinde kendini
gösterir. Gögüs CT taraması opak (taşlanmış cam) gibi bölgeler gösterir (Huang,
C. et al (2020); Wu, Z. et al (2020)). Wuhan’daki ilk 425 vaka göstermiştir ki,
SARS-CoV-2’nin oldukça bulaşıcı olduğunu ve R0= 2.2 çoğlama değerine sahip
olduğunu gösterdi ( (Li, Q. et al (2020)). Bir karşılaştırma yapmak gerekirse,
hem SARS-CoV ve hem de MERS-CoV’un R0 dğeri 1’den küçüktü (Wu, J.T. et al
(2020)).
İlk 44.000 vakada ölüm oranı (% 2.3) düşük
gibi görünse de virüsün hızlı yayılması ve bulaşma kolaylığı küresel alarma
neden oldu. Uzmanlar, virüsün bireysel düzeyde düşük bir sağlık tehdidi
oluştursa da, kolayca bulaşabilmesi nedeniyle toplum düzeyinde önemli bir risk
oluşturabileceğini belirtiyor. Pandemik (tüm dünyaya) potansiyeli göz önüne
alındığında (çevirmenin notu: bu yazı hastalık pandemik olarak görülmeden önce
kaleme alınmıştır), SARS-CoV-2 virüsünün dikkatli bir şekilde izlenmesi,
gelecekteki konak adaptasyonunu, viral evrimini, enfektivitesini, bulaşabilirliğini
ve patojenitesini izlemek için önemlidir (Huang, C. et al (2020)).
Teşhisi
Hem virüsün hem de antikorun tespiti için
standart reaktifler elde edilene kadar SARS’ın tanısı, klinik semptomlar
(belirtiler) ve pozitif epidemiyolojik tarihçesine dayanıyordu. (Cleri, D.J. et
al (2010)). SARS ile ilişkili belirtiler yüksek ateş, öksürük ve nefes almada
zorluktur. Pnömoni veya solunum sıkıntısı sendromu ile uyumlu infiltrasyon
(yayılma) kanıtı varsa, tanı göğüs radyografisi ile doğrulanabilir.
SARS salgını sırasında, FDA ve CDC, SARS
tanı testlerinin doğrulanması ve lisanslanması konusunda işbirliği yaptı.
Teşhis testine yaklaşımlar arasında serolojik tespit, virüsün hücre kültüründe
izolasyon, elektron mikroskopisi ve viral RNA’nın moleküler yöntemlerle saptanması
vardı. Koronavirüs antikorlarının saptanması için hem ELISA hem de
immünofloresan serolojik testler geliştirildi. (Suresh, M.R. et al (2008)).
Bazı hastalar semptomlardan iki hafta sonra saptanabilir anti-SARS virüsü
antikorları geliştirir, ancak ateş başladıktan üç hafta sonrasına kadar kesin
bir negatif tanı konamaz.
SARS-CoV tespitine yönelik tanı
testlerinin hepsinde limitler vardır. ELISA, SARS-CoV’ye karşı yapılan
antikorlar ancak semptomların başlamasından sadece 20 gün sonra tespit eder ve
sadece onay için yararlıdır ve SARS’ın hızlı tanısı için değildir.
İmmünofloresan testi (IFA) semptomların başlamasından 10 gün sonra enfekte
hastaların serumunda antikorları tespit edebilir. Ancak serolojik SARS teşhisi
dışında kalan tek test laboratuvar testidir. semptomların başlamasından dört
hafta sonra antikor için sera negatifse hastalık SARS değildir. (Jernigan, J.A.
et al (2004)). Ne hücre kültürlerinde virüs izolasyonu ne de elektron
mikroskopisi genel tanısal kullanım için yeterince hassas değildir ve her iki
yöntem de sakıncalıdır.
Bir dizi SARS virüsü suşunun RNA dizisi
bilgisi hızlı tanı testlerinin geliştirilmesini kolaylaştırıldı. Polimeraz
zincir reaksiyonuna (RT-PCR) dayalı moleküler testler revers (ters)
transkripsiyona dayalı viral RNA’yı spesifik olarak tespit eder. RT-PCR yegane
erken tanı testidir, ancak duyarlılığı düşüktür ve olası SARS vakalarının
sadece% 37.5-50’sini tanımlar. (Suresh, M.R. et al (2008)). Viral RNA’nın
tespiti, hastalığın başlangıcından yaklaşık 10 gün sonra artar ve zirve yapar.
Virüs, bazı hastalarda solunum salgılarında bir aydan daha uzun süre tespit
edilebilir. Ancak üç hafta sonra virüs kültürden elde edilemez. Enfeksiyondan
sonraki ilk hafta içinde ortaya çıkan ilk aşamada virüs, nazofaringeal
aspiratlar, boğaz bezleri ve balgam örnekleri, sonraki aşamalarda viral RNA
dışkı örneklerinde daha kolay tespit edilebilir (Chan, K.H. et al (2004)).
RT-PCR şu anda gerekli hassasiyeti
verebilen tek hızlı teşhis testidir ve rutin bir klinik teşhis aracı için
gerekli olan özgüllükten dolayı salgın sırasında rutin olarak kantitatif RT-PCR
teknikleri kullanıldı. (Peiris, J.S. et al (2008)). CDC’den gelen bir rapor,
gerçek zamanlı RT-PCR’ın virüs titresi düşük olduğunda erken virüs tespiti
için, geleneksel RT-PCR’dan daha yararlı bir teknik olduğunu gösterdi (Emery,
S.L. et al (2004)). )). Enfeksiyonun başlarında zirve yapan anti-nükleokapsid
protein (NP) antikorlarının ELISA tespiti, Kanadalı araştırmacılar tarafından
SARS tanısı koymanın daha güvenilir ve spesifik bir yöntemi olarak
tanımlanmıştır. (Suresh, M.R. et al (2008)).
Aralık 2019’da, daha sonra SARS-CoV-2
olarak adlandırlam yeni bir koronavirüs ilk olarak Çin’in Wuhan şehrinde akut
solunum yolu hastalığı olan üç hastadan alınan örneklerde bulundu. Virüs
bronkoalveoler lavaj sıvısından izole edilmişti; bununla birlikte, viral RNA
kanda da tespit edilmiştir., Enfeksiyonu tespit etmek için spesifik PCR teşhis
testlerinin üretimini kolaylaştıran SARS-CoV-2’nin genetik sekansı 12 Ocak 2020
WHO’ya sunuldu. (Hui, D.S. et al (2020); Zhu, N. et al (2020)).
Kritik bir gösterge de acil servislere
başvuran hastalarda plazma IL-2, IL-7, IL-10, G-CSF, IP10, MCP1, MIP1A, ve
TNF-alpha’ya dayalı “sitokin fırtınası” olarak bilinen bu sitokinlerin
seviyelerinin yüksek olmasıydı (Huang, C. et al (2020); Zumla, A. et al
(2020)).
5 Şubat 2020’de ABD FDA’sı,CDC’nin Gerçek
Zamanlı RT-PCR Teşhis Panelinin 2019-nCoV için acil kullanımını önerdi. Teşhis,
SARS-CoV-2’nin nazal (burun) veya oral (ağız) swabları gibi solunum
sekresyonlarından tespit edilmesini sağlayan bir RT-PCR testine dayalıdır.
Korunma
Enfeksiyöz ajanlara karşı etkili ilaçlar
veya aşılar henüz olmadığından (Li, G. et al (2020)), sosyal yakınlaşmalardan
geri durma, karantina ve toplumun kendini arındırması coronavirüs salgınına
karşı en iyi önlemler gibi görünmektedir (Wilder-Smith, A.et al (2020)).
Bireysel seviyede hijyen virüsün
yayılmasına karşı önemlidir (Chen, Y. et al (2020)). Virüsün geçişini önlemek
için eller su ve sabunla veya alkolle yıkanabilir. SARS ve diğer koronavirüsler,
oda sıcaklığında metal, cam ve plastik yüzeylerde dokuz güne kadar hayatta
kalabilir, ancak etanol (% 62-71), hidrojen peroksit (% 0.5) veya sodyum
hipoklorit (%0.1) ile dezenfeksiyon yoluyla inaktive edilebilir. (Kampf, G. et
al (2020)). MERS virüsü 20ºC’de 48 saate ve 30ªC’de 24 saate kadar hayatta
kalabilir. (Chan, J.F. et al (2015)). Sağlık personeli için kişisel koruyucu
ekipman (göz dahil) koruma, cerrahi maskeler veya N95 tek kullanımlık
filtreleme maskeleri önerilir (Huang, C. et al (2020)).
Aşılar
Koronavirüs salgınlarının, ölü veya
zayıflatılmış virüs içeren aşılarl çiftlik hayvanlarında başarılı bir şekilde
önlenmesi, aşı çalışmalarının potansiyel başarısına işaret ediyor (Song, Z. et
al (2019); (Ma, C. et al (2014); Zhang, N. et al (2015)). DNA aşıları, vektör
bazlı, canlı ancak zayıflatılmış ve protein alt birimli aşılar dai dahil olmak
üzere, insan MERS-CoV aşıları da şimdilerde geliştirilmektedir (Cho, H. et al
(2018); Schindewolf, C. et al (2019)); Bu aşıların çoğu virüsün Spike (çıkıntı)
proteinini hedef almktadır (Li, F. et al (2019); Song, Z. et al (2019)).
Tedavi
Şu anda SARS, MERS veya başka herhangi bir
koronavirüs enfeksiyonu için onaylanmış ilaç (ilaç, antikor, aşı) tedavisi
yoktur.
Geniş Spektrumlu
Antiviral Ajanlar
Ribavirin, bazı koronavirüsler, solunum
sinsityal virüsü ve metapneumovirüslere karşı aktif olan bir ribonükleozid
analogudur. Nispeten geniş spektrumlu antiviral aktivitesinden dolayı,
ribavirin SARS için klinik etkinliği için test edilen ilk bileşiklerden
biriydi. Ribavirin ile erken tedavi, özellikle kortikosteroidlerle
birleştirildiğinde kullanıldı (Cleri, D.J. et al (2010)). Ribavirin, hafif ila
orta şiddette bir insan hastalığı modeli olan MERS-CoV’nin rhesus makak maymun
modelinde de test edilmiştir. Elde edilen sonuçlar (IFN-a2b artı ribavirin)
virüs replikasyonunu azalttı, konakçı yanıtını hafifletti ve klinik sonucu
iyileştirdi. Bu, MERS hastalarını tedavi etmek için kombinasyonun kullanımını
desteklemektedir (Falzarano, D. et al (2013)).
Antimalariyal ajan klorokin, in vitro
anti-SARSCoV-2 aktivite dahil olmak üzere geniş spektrumlu antiviral ve
antienflamatuar aktiviteye sahiptir. Klorokin, virüsün konakçı hücre ile
füzyonu için gerekli olan endozomal pH’yı arttırarak ve ayrıca SARS-CoV-2’nin
hücresel reseptörlerinin glikozsilasyonu önleyerek etki eder. Bu umut verici
profile, düşük maliyet ve ilacın kolay bulunabilirliğine dayanarak, Covid-19
zatürree tedavisi için klorokin değerlendiren bir klinik çalışma başladı. (Gao,
J. et al (2020)).
Viral Enzim
İnhibitörleri
Koronavirüs replikasyon (çoğalma) süreci
iyi anlaşılmıştır. Birkaç özel adım antiviral ilaçlar için potansiyel hedefler
olarak tanımlanmıştır. Konakçı hücre ile viral füzyon (potansiyel olarak HIV
için kullanılan antivirallere benzer) inhibitörler veya membran füzyon
inhibitörleri tarafından enfeksiyon bloke edilebilir. Viral proteaz
inhibitörleri, viral RNA sentezini inhibe etmek için, polimeraz proteininin
işelenmsine karşı kullanılabilir. Nükleosid inhibitörleri, konak hücreye zarar
vermeden viral replikasyonu inhibe edebilir. Koronavirüslerin viral
enfektivitesini aktive eden serin proteazlara karşı kullanılacak inhibitörler
viral döngüyü engelleyebilir.
(Kilianski, A. et al (2014); Zhou, Y. et
al (2015)); Bir seri konakçı proteazların, virüsün hücreye girmesini sağlayan S
proteinini parçaladığı gösterilmiştir. Bunlar arasında cathepsin, furin and
tripsin sayılabilir (Millet, J.K. et al (2015); Kilianski, A. et al (2014)). S
proteini ayrıca tip II transmembran serin proteazı (TMPRSS2) içeren diğer
konakçı proteazlar tarafından aktive olduğundan, bu enzim de bir antiviral ilaç
hedefi olarak kabul edilir. (Kilianski, A. et al (2014); Li, F.et al (2019)).
Lopinavir/ritonavir proteaz inhibitörü
kombinasyonu MERS-CoV tedavisi için en yaygın denenen yöntem oldu.
Lopinavir/ritonavirin preklinik olarak başarılı değerlendirilmesinin ardından
ilave interferon-beta1b kombinasyonun klinik değerlendirmesi önerildi (Chan,
J.F. et al (2015; Arabi, Y.M. et al (2018)).
Lopinavir ve ritonavir kombinasyonu zaten
mevcut olduğundan Wuhan, Çin’de erken SARS-CoV-2 ile enfekte hastaların
tedavisinde randomize kontrollü bir çalışma COVID-19 için kombinasyonun
etkinliğini ve güvenilirliğini değerlendirmek üzere hızla başlatıldı (Huang, C.
et al (2020)).
RNA-yönlendirilmiş RNA polimaraz (RdRp)
inhibitörü remdesivir showed broad-spectrum antiviral
koronaviruse karşı geniş-spektrumlu antiviral bir aktivite gösterdi ve hem
hayvan orijinli hem de kültürdeki virüslerin replikasyonunu inhibe etti.
(Sheahan, T.P. et al (2017; Sheahan, T.P. et al (2020); Wang, M. et al (2020)).
Şubat ayı sonlarında ABD NIH, COVID-19 teşhisi konan hastanede yatan
yetişkinlerde remdesivirin güvenliğini ve etkinliğini değerlendirmek için
randomize, kontrollü bir klinik çalışmayı Omaha’daki Nebraska Üniversitesi Tıp
Merkezi’nde başlattı.
A ve B influenza tedavisinde kullanım için
onaylanmış bir nükleosid analogu olan Favipiravir, Covid-19
salgında kullanım için potansiyel geniş spektrumlu bir antiviral olarak
tanımlanmıştır. Remdesivir gibi, favipiravir çeşitli RNA virüslerinin
RdRp’larını inhibe eder; Influenzaya ek olarak favipiravir, sarı humma virüsü,
Ebola virüsü, norovirüs ve chikungunya virüsü için de kullanılmıştır (Li, G. et
al (2020)).
Diğer potansiyel antiviral ilaç hedefleri,
virüsün konakçı hücrelerden salınmasını sağlayan; virüs girişi, montajı ve
ekzositozu içerir. Bununla birlikte, viral hedeflerin iyi anlaşılmasına ve in
vitro ve hayvan modellerinde potansiyel antiviral ajanların tanımlanmasına
rağmen, bu bulgular insanlarda etkinliğe dönüşmemiştir. (Zumla, A. et al
(2016); Chen, Y. et al (2020)).
Monoklonal Antikorlar
Monoklonal antikorlar (MAb) ortaya çıkan
hastalıklara karşı genellikle ilk başvurulan savunma hattıdır. Kemirgenlere
ait, kimerik ve tamamen insan antikorları dahil nötrleştirici MAb’lar test
edildi; İnsandan gelen MAb’lar azaltılmış immünojenisiteleri nedeniyle tercih
edilir. (Jin, Y. et al (2017)).
Dana-Farber Kanser Enstitüsü (Harvard
Üniversitesi)’ndeki bilim adamları, SARS-CoV enfeksiyonunu engelleyebilen bir
antikorun insandan izole edildiğini bildirdi . 80R adı verilen antikor, virüsün
hücrelere yapışmasını sağlayan sivri uçlu (Spike, S) glikoproteinini hedefler
ve virüsün ACE2 reseptörlerine bağlanmasını engeller. Antikor, hayvan
modellerinde test edildi ve akut akciğer hasarına karşı koruduğu saptandı.
Böyle bir antikorun, SARS-CoV enfeksiyonunun erken tedavisi için pasif
aşılamada kullanılması öngörülüyor (Sui, J. ve ark. (2004); Cleri, D.J. ve
diğerleri (2010)). Bununla birlikte, daha sonraki çalışmalar, antikorun geniş
ölçüde koruyucu olmadığını, 2003-2004 SARS-CoV salgını ile ilişkili farklı bir
SARS suşuna karşı etkisiz olduğunu gösterdi (Cleri, D.J. ve diğerleri (2010)).
Ulusal Kanser Enstitüsü’ndeki (NCI)
araştırmacılar, 80R’a göre iki yeni antikorun ACE2 reseptörü için yüksek
afiniteye sahip olduğunu rapor ettiler. Araştırmacılar, M396 ve S230.15 olarak
adlandırdıkları bu monoklonal antikorların (MAb’ler), modelleme çalışmalarında
tüm SARS-CoV izolatlarını etkisiz hale getirdiklerini gösterdiler (Zhu, Z. ve diğerleri
(2007)).
ABD’li ve Çinli araştırmacılar, monoklonal
antikorlar kullanarak Ortadoğu Solunum Sendromu (MERS) koronavirüsünün
nötralizasyonunu sağladılar. Geniş bir muhtemel antikor kütüphanesi taranarak
MERS-CoV’in sivri uçlu glikoprotein reseptörünü (CD26 / DPP4) hedef alan üç MAb
in vitro olarak tanımlandı. MAb m336,virüsü olağanüstü bir şekilde etkisiz hale
getirdi ayrıca reaktif olarak büyük bir potansiyele sahip olduğunu ve MERS-CoV
aşılarının geliştirilmesini kolaylaştırmak için terapötik bir aday olduğu
bildirdi (Ying, T. ve diğerleri (2014)). Japon araştırmacılar ayrıca MERSCoV
için anti-CD26 MAb’yi araştırdı ve insan için uyarlanmış MAb YS110’un umut vaat
rapor etti.(Ohnuma,K. ve ark. (2013)).
İnterferonlar
Doğal interferon yanıtı dahil olmak üzere,
konakçı immün yanıtı; viral replikasyonun kontrolü için çok önemlidir.
Koronavirüsler bağışıklık sisteminden kaçınmak için bu yanıtı baskılarlar.
Bununla birlikte, koranavirüslere karşı
interferonlar, özellikle rekombinant formlarları kullanılabilir (Zumla, A. ve
ark. (2016)). İnterferon-beta, interferon-alfa ve interferon-gama’nın antiviral
aktivitesi hastalardan izole edilen SARS-CoV suşlarında değerlendirildi ve Vero
ve Caco-2 hücre hatlarında çoğaltıldı (Hensley, L.E. ve diğerleri (2004)). IFN-beta,
her iki hücre hattındada SARS-CoV replikasyonunu inhibe eden iyi bir antiviral
aktivite gösterdi. IFN-alfa da aktifti, ancak IFN-beta’dan 50 ila 90 kat daha
düşük bir duyarlılık indeksi gösterdi. IFN-gamma bir hücre hattında
IFN-alfa’dan biraz daha fazla aktif iken başka bir hücre hattında hiç etki
göstermedi (Cinatl, J. ve ark. (2003)). In vitro olarak, interferon alfa ile
tedaviye, MERS-CoV’nin SARSCoV’dan 50 ila 100 kat daha duyarlı olduğu
gösterilmiştir (Abdel-Moneim, A.S. (2014)).
Bir çalışma, Klinik olarak onaylanmış 19
antiviral ilacı arasında, Alferon N’nin (interferon alfa-n3) SARS-CoV’ye karşı
en güçlü antiviral aktiviteye sahip olduğunu gösterdi. (Tan, E.L. ve diğerleri
(2004)).
Kortikosteroidler
Çin hükümeti, hepatit B için kullanılan
bağışıklık sistemini güçlendirici etkiye sahip SciClone’s Zadaxin (timozin alfa
1)’nin SARS salgını sırasında kullanılmasına onay verdi. Zadaxin, vücuda
enfeksiyon ile savaşma yeteneği kazandırıp, beyaz kan hücrelerinin üretimini
sağlıyor. Her ne kadar ürünün SARS tedavisi üzerindeki etkinliği hakkında kesin
veri mevcut olmasa da, bu ve diğer bulaşıcı enfeksiyonlar için bazıları
tarafından umut verici bir tedavi yöntemi olarak kabul edililiyor(Goldstein,
A.L. ve diğerleri (2009)).
Hepatit koronavirüsleri ile enfekte olan
farelerde, Ribavirin proinflamatuar (yangıya sebep olan)
sitokinlerin salınımını azaltır ve aynı zamanda bir immünomodülatör görevi de
görebilir (Peiris, J.S. ve ark. (2003)). In vitro çalışmalar diğer virüsleri
inhibe eden ribavirinin ,SARS-CoV replikasyonunu inhibe etmek için yeterli
olmadığını gösterdi (Normile, D. (2003)). Bu nedenle, Ribavirin’in faydası onun
immünomodülatör aktivitesinden kaynaklanmış olabilir (Mazzulli, T. ve diğerleri
(2004).